
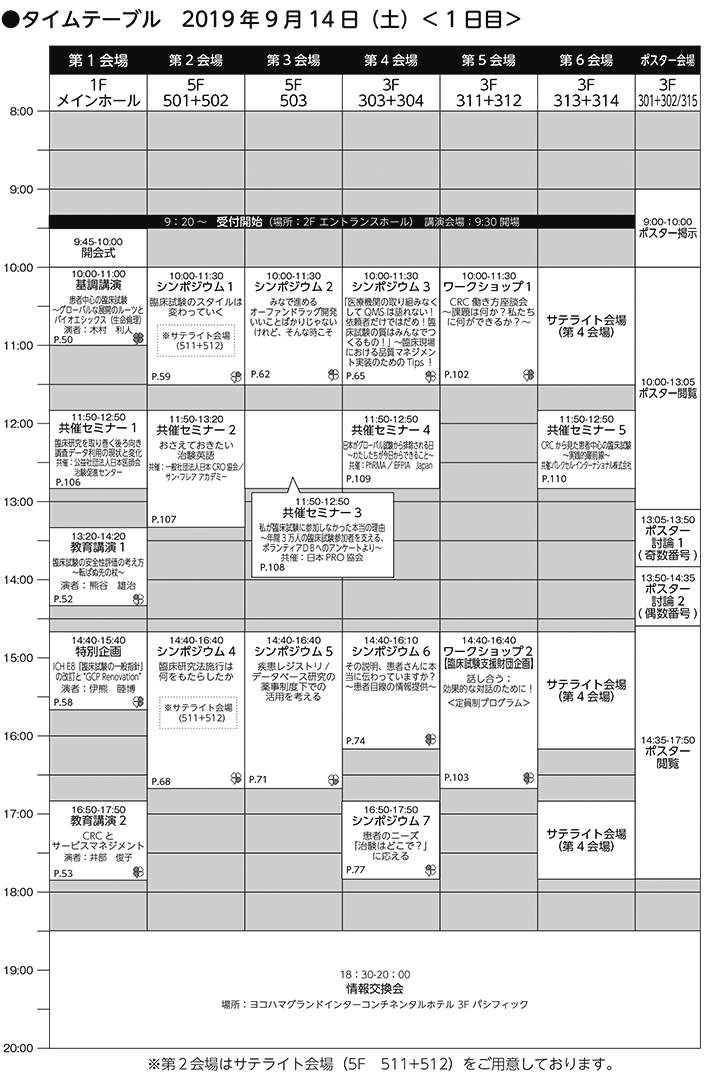
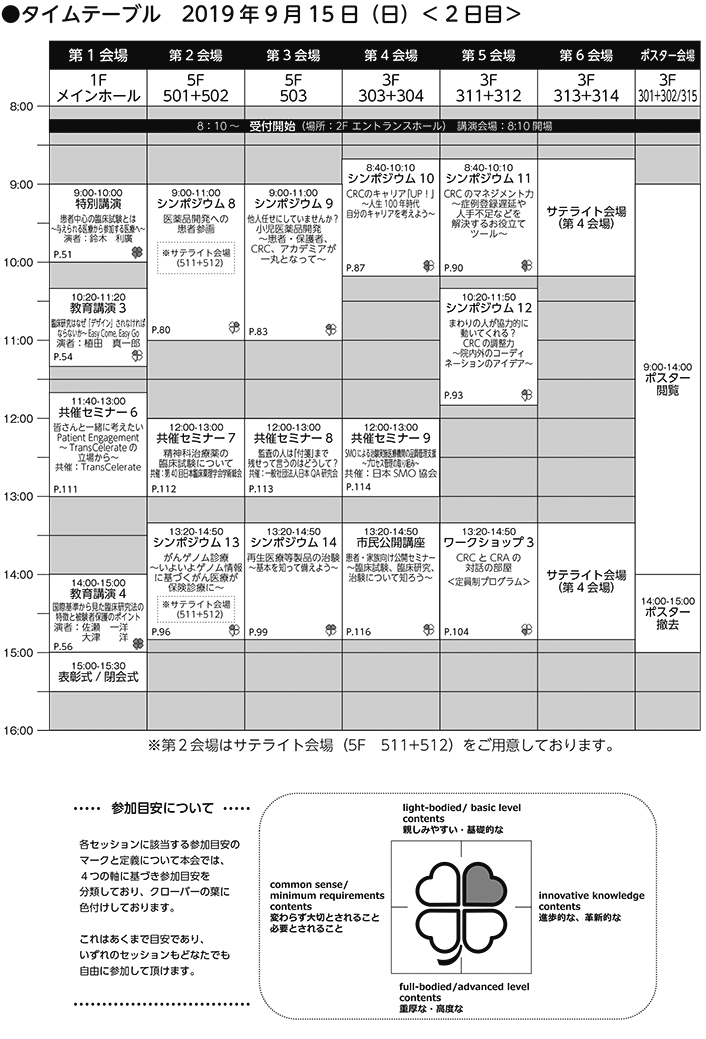
プログラム・日程
<タイムテーブルのセッション名をクリックするとセッション概要をご覧いただけます>
基調講演
9月14日(土) 10:00~11:00
第1会場
患者中心の臨床試験
~グローバルな展開のルーツとバイオエシックス(生命倫理)
| 座長: | 前田 実花 | (学校法人北里研究所 北里大学病院 Human Research Protections室/薬剤部) |
| 演者: | 木村 利人 | (早稲田大学 名誉教授/ジョージタウン大学ケネディ倫理研究所 特任研究員) |
特別講演
9月15日(日) 9:00~10:00
第1会場
患者中心の臨床試験とは ~与えられる医療から参加する医療へ~
| 座長: | 田代 志門 | (東北大学大学院 文学研究科・文学部 総合人間学専攻 社会人間学講座 社会学分野) |
| 演者: | 鈴木 利廣 | (明治大学 名誉教授・学長特任補佐/すずかけ法律事務所・弁護士) |
教育講演
教育講演 1
9月14日(土) 13:20~14:20
第1会場
臨床試験の安全性評価の考え方 ~転ばぬ先の杖~
| 座長: | 近藤 充弘 | (日本製薬工業協会 医薬品評価委員会 臨床評価部会) |
| 演者: | 熊谷 雄治 | (学校法人北里研究所 北里大学病院 臨床試験センター) |
教育講演 2
9月14日(土) 16:50~17:50
第1会場
CRCとサービスマネジメント
| 座長: | 森下 典子 | (国立病院機構本部 総合研究センター 治験研究部 治験推進室) |
| 演者: | 井部 俊子 | (長野保健医療大学 看護学部/株式会社井部看護管理研究所) |
教育講演 3
9月15日(日) 10:20~11:20
第1会場
臨床研究はなぜ「デザイン」されなければならないか
~Easy Come, Easy Go
| 座長: | 近藤 直樹 | (国立研究開発法人 国立国際医療研究センター病院 臨床研究センター 治験管理室) |
| 演者: | 植田 真一郎 | (琉球大学大学院医学研究科 臨床薬理学) |
教育講演 4
9月15日(日) 14:00~15:00
第1会場
国際基準から見た臨床研究法の特徴と被験者保護のポイント
| 座長: | 上竹 勇三郎 | (東京大学大学院医学研究科 医学部 研究論理支援室) |
| 演者: | ~患者を中心とした臨床試験における研究責任医師の役割~ | |
| 佐瀬 一洋 | (順天堂大学大学院医学研究科 臨床薬理学/早稲田大学医療レギュラトリーサイエンス研究所) | |
| ~患者を中心とした臨床研究における生物統計家の役割~ | ||
| 大津 洋 | (国立研究開発法人 国立国際医療研究センター 臨床研究センター/早稲田大学医療レギュラトリーサイエンス研究所) | |
特別企画
9月14日(土) 14:40~15:40
第1会場
ICH E8「臨床試験の一般指針」の改訂と”GCP Renovation”
| 座長: | 近藤 充弘 | (日本製薬工業協会 医薬品評価委員会 臨床評価部会) |
| 演者: | 伊熊 睦博 | (独立行政法人医薬品医療機器総合機構 新薬審査第一部) |
国内では「臨床試験の一般指針」として馴染みが深いICH E8は、1997年に出されて以来約20年改訂されることなく活用されてきたが、近年医薬品開発が求められる領域が希少・難治疾患等に焦点が向けられると共に、個別化医療等の促進、臨床試験デザインや開発手法、活用するデータソースなどの多様化にも対応できるように、被験者の保護とデータの信頼性確保を大前提に議論が進められることが期待された。
“GCP Renovation”では、ICH E8(「臨床試験の一般指針」)で大きな考え方を示し、その後、実務に直結してくるICH E6の議論を進めることが提案されているが、“GCP Renovation”の大きな主旨としては「臨床試験の目的や状況に応じて満たすべき基準は変わるため、その目的や状況に合わせて被験者保護とデータの信頼性を確保しながら柔軟に対応できるような指針としていく」ということになるだろう。
本年5月に国内でも「ICH E8(R1) 臨床試験の一般指針 ガイドライン(案)」に関する意見募集が開始された。ガイドライン(案)の目的として4つ挙げられているが、その3つ目には「医薬品のライフサイクルを通して実施される臨床試験の種類の概要を提供し、それら臨床試験について、試験の被験者の保護、データの完全性(integrity)、結果の信頼性及び試験の目的を達成するための能力を保証するためには質に関するどの因子が重要であるかの決定を支援するための側面を記述すること」と記載されており、従来の臨床試験実施の際の考え方とは少し異なった視点も必要となる。
今回、”GCP Renovation”の第一段階であるICH E8改訂案の概略について解説いただき、今後の我々の活動や準備のための参考にしていきたい。
シンポジウム
シンポジウム 1
9月14日(土) 10:00~11:30
第2会場
臨床試験のスタイルは変わっていく
| 座長: | 今村 恭子 | (東京大学 大学院薬学系研究科) |
| 佐藤 貴之 | (日本製薬工業協会 臨床評価部会) | |
| 演者: | 新しい臨床試験の実施に向けて 製薬企業の立場から | |
| 北村 篤嗣 | (ファイザーR&D合同会社) | |
| 新しい臨床試験スタイル ~バーチャルトライアルの実現に向けて~ | ||
| 氏原 真美 | (IQVIAサービシーズ イノベーション・オフィス) | |
| 患者中心の医薬品開発のあり方 | ||
| 今村 恭子 | (東京大学 大学院薬学系研究科) | |
| 臨床試験の新たな形 ~訪問治験実施の経験から~ | ||
| 長嶋 浩貴 | (医療法人社団 知正会東京センタークリニック) | |
現在の臨床試験は患者が実施医療機関に来院して評価を行う方法が主流であるため、周辺に実施医療機関がない患者は臨床試験へ参加することが困難である。また、試験デザインが複雑化、あるいは希少疾患を対象とした臨床試験が増えており、来院回数等の患者負担を考慮する必要もある。今後、臨床試験に関する情報公開が進み、今以上に患者自身が臨床試験に関する情報を収集可能になった場合でも、実施医療機関へのアクセスが理由で参加が困難になることも考えられる。これは、患者の臨床試験への参加機会を奪うだけでなく、効果的に臨床試験データを取得し、いち早く患者に医薬品を届けるという面でもマイナスである。近年、モバイルデバイスやウェアラブルデバイス等のIoT(Internet of things)の進化により、モノや機器がインターネットを通じて直接繋がることで人を介さずに様々なデータを収集することができるようになってきた。医療分野でも、IoT機器を介して患者と医療機関が相互に通信することで、従来は医療機関へ来院しなければ収集できなかった様々な臨床データを遠隔でリアルタイムに収集することができ、またIoT機器を利用して患者のサポートも行えるようになってきた。欧米を中心に、モバイル等を活用して患者から直接データを収集し、患者が実施医療機関へ来院せずに評価を行う新しいスタイルの臨床試験が始められつつある。このような臨床試験はVirtual trial, Remote trial, Decentralized Clinical Trials等、様々な用語で呼ばれているが、国内ではまだ馴染みが薄い。この新しいスタイルの臨床試験を進めるには、被験者の保護、臨床試験内容の理解・教育、患者登録から評価までの実施体制構築について、今までの臨床試験とは異なった視点での対応が重要となってくる。本シンポジウムでは、この新しいスタイルの臨床試験を実施する際に考慮しなければならない点は何かを「被験者保護」、「臨床試験の体制」、「CRCの役割」、「教育」等、様々な視点から考えたい。
シンポジウム 2
9月14日(土) 10:00~11:30
第3会場
みなで進めるオーファンドラッグ開発
いいことばかりじゃないけれど、そんな時こそ
| 座長: | 中村 治雅 | (国立研究開発法人国立精神・神経医療研究センター トランスレーショナル・メディカルセンター) |
| 西村 由希子 | (特定非営利活動法人Asrid) | |
| 演者: | 患者さんに寄り添った医薬品等の開発とは? | |
| 島崎 茂樹 | (ノーベルファーマ株式会社 研究開発本部) | |
| 希少疾病治験の中止を経験して ~CRCが思うこと・できること~ | ||
| 太幡 真紀 | (国立研究開発法人国立精神・神経医療研究センター 臨床研究推進部) | |
| 臨床試験における患者及び患者会の役割 | ||
| 織田 友理子 | (特定非営利活動法人PADM) | |
患者数が非常に少なく、診断法や治療法の確立していない疾患を希少疾患(レアディジーズ、Rare disease)とよび、このような疾患に対する医薬品をオーファンドラッグ(Orphan drug、Orphanは孤児の意味)と呼びます。多くの希少疾患は、アンメットメディカルニーズの高い疾患であり、治療法開発は非常に期待が高いにも関わらず、その開発自体は病態解明が十分に進んでいないことや希少性により市場が小さい、治験実施が困難であることなどから、なかなか進まないと言われてきました。しかしながら、昨今では希少疾患における治療法開発が世界的に活発になってきており、国内外ともに多くの治験が実施され、革新的な医薬品、医療機器等が出現しています。
希少疾患の患者さんにとって新しい治療法開発は大きな希望であり、うまくいくに越したことはありません、しかし、一般的には医薬品等の開発成功率は低いもので、必ずしも成功することばかりではありません。皆が、それぞれの思いを持って取り組んできた研究、治験が何らかの理由でうまく進まなかった時、あと少しで患者さんに届けられるはずだった治療法が足踏みしてしまった時、それぞれの関係者は何を思い、またどのような対応をしたのか、それぞれの立場でどのような困難があったのでしょうか。
本シンポジウムでは、必ずしもいいことばかりでもないまさにその時、開発に関わる企業の方、治療法を待ち望む患者さんご自身、治験の現場で患者さんに関わってきたCRC、それぞれの経験などを共有していただき、そんな時こそ、患者さん含めた全てのステイクホルダーの皆さんが協力していけるよう、みなさんと考えていきたいと思います。
シンポジウム 3
9月14日(土) 10:00~11:30
第4会場
「医療機関の取り組みなくしてQMSは語れない!依頼者だけではだめ!臨床試験の質はみんなでつくるもの!」
~臨床現場における品質マネジメント実装のためのTips!~
| 座長: | 小林 典子 | (国立研究開発法人国立がん研究センター中央病院 臨床研究支援部門 研究実施管理部 臨床研究コーディネーター室) |
| 長尾 典明 | (日本たばこ産業株式会社 医薬事業部 臨床開発部) | |
| 演者: | 治験や臨床試験の品質マネジメントに必要なこと ~医療機関で感じること~ |
|
| 山崎 純子 | (神戸大学医学部附属病院 臨床研究推進センター) | |
| CRC・CRAがまず取り組めること ~CRCと治験依頼者側の業務を経験した立場から~ |
||
| 石橋 寿子 | (小野薬品工業株式会社 クリニカルオペレーション一部 第一課) | |
| 臨床試験における品質マネジメントの現状とこれから | ||
| 長尾 典明 | (日本たばこ産業株式会社 医薬事業部 臨床開発部) | |
ICH E6(R2)にQuality Management System(QMS)の概念が明記されて以降、各組織ではQMSの実装へ向けた検討や取り組みがなされている。特に製薬企業側では、TransCelerateが提唱するRACTなどのツールを活用したQMSの構築及び実装が行われている。しかし、それらのツールを使うこと、新たに検討した品質マネジメントの手順を遵守すること自体がQMSの目的になっている状況も見受けられる。さらに、ICH E6(R2)においてQMSがスポンサーの責務とされており、製薬企業側の視点を中心に検討されていることから、医療機関側にとって適切なQMSとはならないこともあり、医療機関側においてのQMSの理解が難しいものとなっている現状がある。本来、医療機関では、患者さんが安心できる医療環境のもとで、安全かつ適切な医療が受けられるように医療安全管理指針を備えている。そのため、臨床試験の実施においても、その指針のもと、臨床試験の手順に従って試験が実施されている。このことから、本来、医療機関側にとってもQMSは身近なものであること、また、製薬企業側のみで考えるものではないことを再確認していく必要がある。そして、医療機関側と製薬企業側の双方にとってより良い臨床試験の実施のための意義のある品質マネジメントを実装するためには、現場で密にコミュニケーションをとるCRCとCRAが臨床試験の目的を達成するという共通の目標を目指して、共に考え行動することにより効果的なRisk Based ApproachやRisk Based Monitoringを実施することが不可欠であると考える。
そこで、本セッションでは、医療機関における具体的な品質マネジメントの取り組みや医療機関と製薬企業の双方の立場を知るからこそのアドバイス、また、事前のアンケートにより収集した現場の声を盛り込みながら、参加者と相互にコミュニケーションを取りながらQMSの理解が深まる場を目指す。その中で、臨床試験における品質マネジメント実装のために明日から出来ること、そして、CRCとCRAがそれぞれの得意分野を活かしてできることについての考えも深めていきたい。
事前アンケートを終了いたしました。ご協力ありがとうございました。
シンポジウム 4
9月14日(土) 14:40~16:40
第2会場
臨床研究法施行は何をもたらしたか
| 座長: | 山本 洋一 | (大阪大学医学部附属病院 未来医療開発部 臨床研究センター) |
| 笹山 洋子 | (和歌山県立医科大学附属病院 臨床研究センター 臨床研究管理部門) | |
| 演者: | 現場から見た臨床研究法運用上の問題点と今後に向けた提言 | |
| 中村 健一 | (国立研究開発法人国立がん研究センター中央病院 臨床研究支援部門 研究企画推進部) | |
| 臨床研究法の統一書式等見直し作業からみえてきたもの ~CRC働き方改革の必要性~ |
||
| 山本 洋一 | (大阪大学医学部附属病院 未来医療開発部 臨床研究センター) | |
| 臨床研究法への対応と課題、そして期待 | ||
| 寺元 剛 | (北海道大学病院 臨床研究監理部) | |
| 臨床研究法施行に伴うCRC支援の課題 | ||
| 中濱 洋子 | (国立研究開発法人国立がん研究センター中央病院 臨床研究支援部門) | |
2018年4月1日に臨床研究法が施行され、2019年3月末には実施中の特定臨床研究における1年間の経過措置期間も終了した。本法律施行により、我が国で初めて臨床研究に法的な規制が課せられた。研究責任医師に、認定臨床研究審査委員会における実施計画の審査、厚生労働大臣への実施計画の届出、実施基準の遵守への対応等が義務づけられ、研究者の負担は増大した。また、認定臨床研究審査委員会の体制整備や運営への対応においては、医療機関等で相当な労力を要した。
2019年9月には本法律施行1年半を迎えるが、臨床研究を実施する現場ではまだまだ問題も多くある。CRCの臨床研究法に対する理解は十分ではなく、多くの医療機関においては、臨床研究の支援まで実施できていない状況である。
各医療機関等の運用上の工夫や取り組み等の情報を知ることで、医療現場での研究者だけでなくCRCのモチベーションが向上し、臨床研究法規制下の研究を推進できるのではないかと考えられる。
本シンポジウムでは、法律や基準等の内容を正しく学ぶための貴重な場として活用いただくのみならず、臨床研究の実施に中心的な役割を果たしている演者の方々の講演とパネルディスカッションを通して、本法律が適用される臨床研究においてCRCに期待されている役割について考える機会としたい。
シンポジウム 5
9月14日(土) 14:40~16:40
第3会場
疾患レジストリ/データベース研究の薬事制度下での活用を考える
| 座長: | 山口 拓洋 | (東北大学大学院医学系研究科 医学統計学分野) |
| 森本 陽子 | (メディデータ・ソリューションズ株式会社 GCS部門) | |
| 演者: | MID-NETの現状と取組み | |
| 岡田 佑輔 | (独立行政法人医薬品医療機器総合機構(PMDA) 医療情報活用部 疫学課/MID-NET運営課) | |
| クリニカル・イノベーション・ネットワーク(CIN)推進拠点事業について | ||
| 泉 和生 | (国立研究開発法人国立国際医療研究センター 臨床研究センター) | |
| リアルワールドデータに対する期待(製薬企業の立場から) | ||
| 西馬 信一 | (日本製薬医学会/セルジーン株式会社 医学本部) | |
| CRCとしての疾患レジストリへの関わり 海外レジストリ事務局訪問も踏まえて | ||
| 原田 裕子 | (国立精神・神経医療研究センター 臨床研究推進部) | |
リアルワールドデータ(RWD)を取り巻く薬事規制の環境は、医薬品等開発、製造販売後のいずれのフェーズにおいても、今まさに、大きな変革を迎えています。
医薬品開発に関しては、ICHにおけるE8ガイドライン(臨床試験の一般指針)の近代化とその後に続くE6ガイドライン(ICH-GCP)の改訂「GCP Renovation」があげられます。実際的臨床試験(Pragmatic Clinical Trial)や患者レジストリデータを用いたランダム化比較試験、さらにRWDを全部又は一部用いる非介入の観察研究までも対象範囲となると言われています。この動きは、米国における「21st Century Act(21世紀治療法)」においても取り上げられ、臨床試験の合理化がうたわれ、適応拡大の承認審査の際にRWDが用いられる事例も出ています。また、日本においても、クリニカル・イノベーション・ネットワーク(CIN)構想のもと、患者レジストリ等の承認審査資料として用いることの検討が進んでいます。次に、製造販売後に関しても、医療情報データベース(MID-NET)事業やCIN構想における患者レジストリのようなRWDを用いた製造販売後の有効性・安全性の確認が検討され、「医薬品の製造販売後の調査及び試験の実施の基準に関する省令(いわゆるGPSP省令)(平成29年10月26日、厚生労働省令第116号)」において、MID-NET等の医療情報データベースを用いて実施する調査である「製造販売後データベース調査」が新たに規定されました。
本シンポジウムでは、RWDの医薬品等承認審査や製造販売後の安全性監視に関する薬事制度下での利活用の現状、課題などについて、医薬品医療機器総合機構からMID-NET事業、CIN拠点をご担当されている先生からCIN含めた動き、リアルワールドデータの活用に対する企業側からの期待、そしてレジストリに関わるCRCの経験についてお話しいただき、今後の方向性について情報共有したいと思います。
シンポジウム 6
9月14日(土) 14:40~16:10
第4会場
その説明、患者さんに本当に伝わっていますか?
~患者目線の情報提供~
| 座長: | 日比野 文代 | (昭和大学江東豊洲病院 臨床試験支援室) |
| 佐藤 淳子 | (独立行政法人医薬品医療機器総合機構 国際部) | |
| 演者: | 治験依頼者による説明文書の見本作成について | |
| 白井 利明 | (日本製薬工業協会 医薬品評価員会 臨床開発部) | |
| 治験責任医師として心がけてきたこと | ||
| 藤原 康弘 | (国立がん研究センター中央病院 乳腺・腫瘍内科) | |
| 患者ブログ記事を使用した治験参加における意思決定支援のニーズアセス メント |
||
| 藤田 美保 | (昭和大学横浜市北部病院 臨床試験支援室) | |
| 「説明不足」を訴える理由の真相とは | ||
| 山口 育子 | (認定 NPO法人ささえあい医療人権センターCOML) | |
同意説明文書等の患者やその家族向けの文書は、製薬企業が同意説明文書見本を作成し、医療機関で使用する同意説明文書(案)として修正され、治験審査委員会の審議を受けて医療機関にて患者やその家族向けに説明する文書として最終化される。患者やその家族向けの文書でありながら、同意説明文書等の作成過程で、患者等の欲する情報が記載されているか、理解できる記載となっているか等について、文書最終化までの段階で、患者やその家族の意見を聴取されているだろうか?もちろん製薬企業も医療機関も上記の点について留意しつつ文書の最終化を行っているに違いない。しかしながら、「患者が現状のどのような点に不満を抱いているか」、「どのような説明の仕方であれば理解しやすいのか」等については、想像の範囲で対応されている場合が多く、患者等の意見を聴き、その意見を少しでも解決できるような同意説明文書等を作成している事例は少ないように思う。
治験に参加する患者やその家族の中には、治験の説明を聞く時に初めて「治験」という言葉に触れる人も多いだろう。治験自体に不安を感じている人もいるだろう。医薬品開発に協力したいという思いを持っているけれども、記載されている内容が難しく治験のことが分からず不安に思う人もいるだろう。私達が、あらかじめ患者やその家族の意見や気持ちを理解し、できるだけ反映した同意説明文書を作成するようにしていかなければ、「患者と一緒に医薬品開発をする」という第一歩にもならない。
このシンポジウムでは、治験に参加する患者やその家族に「伝えたいことが本当に伝わっているのか?」、「知りたいことを反映できているのか?」など、「患者の目線で同意説明文書を作成しているのか?」という現状の問題点についてまず共通理解としたい。また、患者フレンドリーな同意説明文書作成経験や患者視点の意見などを参考にして、良いところを拡大し、我々に足りなかった部分を皆が意識して今後の活動に結び付けることができるように、第一歩目を踏み出す糸口を様々な視点から議論したい。
シンポジウム 7
9月14日(土) 16:50~17:50
第4会場
患者のニーズ「治験はどこで?」に応える
| 座長: | 渡部 歌織 | (東京大学医学部附属病院 臨床研究支援センター) |
| 神山 和彦 | (IQVIA サービシーズ ジャパン株式会社) | |
| 演者: | 治験実施医療機関名の公開の現状と課題 ~製薬企業の立場から~ | |
| 服部 龍司 | (ファイザーR&D合同会社) | |
| 「治験はどこで?」に応えるために私たちにできること | ||
| 後澤 乃扶子 | (国立研究開発法人国立がん研究センター 研究支援センター 研究管理部) | |
| 患者への治験情報のあり方 | ||
| 山口 育子 | (認定 NPO法人ささえあい医療人権センターCOML) | |
「患者を中心とした臨床試験」の実現を考えるにあたり、治験情報を積極的に公開することは、どのような治験が行われているかを患者が把握・理解するうえで重要になる。これまで日本で治験情報の公開は法律・ガイドラインなどにより義務化されていたわけではなく、各製薬企業の自主性に委ねられていた。2018年4月に臨床研究法が施行され、臨床研究の情報を厚生労働省が整備するデータベース(jRCT)へ登録して公開することが規定され、また2018年3月26日の審査管理課長通知では、届出を行う治験は国内の3つの臨床試験情報登録センターに日本語と英語で情報を登録するよう義務化された。今後は治験の情報登録も進み、患者による検索やアクセスが容易になることが期待される。
一方、難治性疾患領域、特にアンメットメディカルニーズの高い領域においては、治験を含めた臨床研究が治療選択肢の一つになりうる。治療選択肢の一つとして治験を含めた臨床研究を求める患者や担当医師にとって、「どこで」どのような治験が行われているのか?ということは、非常に有意義な情報となりうる。製薬企業は、「治験実施医療機関名は、治験の成否を分ける秘匿性の高い情報」という意見もあり、これまでJAPIC等臨床試験登録サイトにも医療機関名が公開されることは少なかった。また、医療機関名非公開の理由として「医療機関が公開を許可しない(問い合わせに対応するリソースの問題)」という点もあり、治験も含めた治療選択肢を求めている患者の最も近い現場が自ら機会を限定している可能性もある。
本シンポジウムでは、患者のニーズに応えるために、医療機関側、製薬企業側それぞれができることを一緒に考えて、一歩踏み出すきっかけにしたい。
シンポジウム 8
9月15日(日) 9:00~11:00
第2会場
医薬品開発への患者参画
| 座長: | 佐藤 淳子 | (独立行政法人医薬品医療機器総合機構(PMDA) 国際部) |
| 神山 和彦 | (IQVIA サービシーズ ジャパン株式会社) | |
| 演者: | 研究への患者・市民参画を考える | |
| 武藤 香織 | (東京大学 医科学研究所) | |
| ゲノム医療に関する医薬品開発と患者支援団体の役割 | ||
| 眞島 喜幸 | (特定非営利活動法人パンキャンジャパン) | |
| 患者の声を活かした医薬品開発の実装に向けた製薬企業の取り組みと今後の展望 | ||
| 松山 翔 | (製薬協 臨床評価部会) | |
| 薬事行政における患者参画の取組みについて | ||
| 山本 剛 | (独立行政法人医薬品医療機器総合機構(PMDA) 経営企画部 広報課 患者参画検討ワーキンググループ) | |
近年、患者・市民参画は医薬品開発の過程においても重要視されており、海外では、すでに規制当局や、官民連携、患者団体等で積極的に取り組まれている。わが国でも、がん対策基本法に基づくがん対策推進計画(2017年)において、「AMEDは、海外の研究体制と同様、我が国でも患者やがん経験者が研究のデザインや評価に参画できる体制を構築するため、2018年度より、患者及びがん経験者の参画によって、がん研究を推進するための取り組みを開始する。また、国は、研究の計画立案と評価に参画可能な患者を教育するためのプログラムの策定を開始する。」とされている。これを受け、AMEDでは患者参画についての事業を2017年度より開始し、ホームページにおいて研究への患者・市民参画ガイドブックを2019年4月に公開している。
また、製薬企業でも、日本製薬工業協会(製薬協)を中心に「患者参加型医療」を実現するために、製薬協は患者団体との協働を推進しており、2002年から「患者団体セミナーの開催」、2011年より「患者団体アドバイザリーボードの開催」、2012年には「企業活動と患者団体の関係の透明性ガイドライン」を策定、2016年からは製薬企業でのPatient Centricity 活動の実装をめざし「患者の声を活かした医薬品開発(Patient Centricity)」という報告書をまとめ公表するなど 活発な活動している。
しかしながら、医師、CRC、患者にはこれら国や製薬企業の取組が十分理解されていないのが現状である。
本シンポジウムでは、患者参画に対する最新の国内外の現状と取り組みを紹介し、患者側の視点でのこの取組に対する期待や懸念を理解し、国やCRCを含めそれぞれの立場で今後どのように取り組むべきかについて考える場としたい。
シンポジウム 9
9月15日(日) 9:00~11:00
第3会場
他人任せにしていませんか?小児医薬品開発
~患者・保護者、CRC、アカデミアが一丸となって~
| 座長: | 中村 秀文 | (国立研究開発法人国立成育医療研究センター 臨床研究センター) |
| 友常 雅子 | (東京都立小児総合医療センター 臨床研究支援センター) | |
| 演者: | 法改正を踏まえた小児医薬品開発への新たな展開 | |
| 市川 雄大 | (医薬品医療機器総合機構(PMDA) 新薬審査第一部) | |
| 国内外における小児医薬品開発推進への取り組み:アカデミアの視点から | ||
| 中村 秀文 | (国立研究開発法人国立成育医療研究センター 臨床研究センター) | |
| 小児治験ネットワークにおける小児CRC部会の取り組み | ||
| 山﨑 美智子 | (大阪母子医療センター 治験推進室) | |
| 海外での小児アドバイザリーボードの活動と国内の取り組み | ||
| 原田 努 | (昭和大学 薬学部) | |
| 米国における新生児医薬品開発への患者家族・看護関係者の貢献 | ||
| エクランド 源 稚子 | (Pediatrix Medical Group of Tennessee, Nashville, TN) | |
欧米では小児医薬品開発が法律で義務化され、小児のみならず新生児でも医薬品開発が進んでいます。また、小児の薬物治療に関わるすべてのステークホルダーが積極的に小児医薬品開発に関わる風潮が高まっています。一方、我が国の小児医薬品開発は欧米に比べて遅れており、ドラッグラグの問題は未だ解決していません。また関係者の連携も不足しています。しかし、日本小児科学会をハブとしてオールジャパンで開発を支援する「小児医薬品開発ネットワーク」の構築が2017年から開始され、また医薬品医療機器等法の改正案に、小児医薬品開発を促進する制度の新設が盛り込まれるなど、今後小児医薬品開発がより進むことが期待されています。そこでこの機会に患者・保護者・CRCを含む医療者・企業開発関係者等のすべての関係者のより良い連携の在り方について議論できないかと考えました。多くの医療機関では、企業の立案した治験計画をそのまま受身で実行せざるを得ないのが実情ではないでしょうか。受身で治験をやるだけでは、我が国の現場目線の良い治験は行えないと思われます。欧米で始まっているように関係者が協力して働きかけるべきでしょう。世界的には、小児医薬品開発にCRC、看護師、保護者、そして患者本人も積極的に関わり始めています。そのような関係者が一堂に集まり議論するコンソーシウムも設立されつつあります。本シンポジウムでは、規制当局、アカデミア、現場CRC、そして国内外での患者・保護者・看護師の取り組みについてご紹介頂き、小児医薬品開発のためのよりよい連携について議論を行いたいと考えています。皆で連携して、オールジャパンで小児開発を進められれば、小児医薬品開発はより進むのではないでしょうか。
シンポジウム 10
9月15日(日) 8:40~10:10
第4会場
CRCのキャリア「UP!」
~人生100年時代 自分のキャリアを考えよう~
| 座長: | 阿部 八千代 | (独立行政法人国立病院機構本部 総合研究センター 治験研究部) |
| 若林 薫 | (東京都済生会中央病院 臨床研究センター) | |
| 演者: | CRCとしての多くの転機と、それにより得られた経験 | |
| 祢宜元 朱美 | (日本SMO協会/株式会社EP綜合) | |
| キャリア支援の立場からCRCのキャリアUPを考える | ||
| 安藤 幸子 | (名古屋大学医学部附属病院 先端医療開発部 先端医療・臨床研究支援センター) | |
| 治験依頼者側からCRCを応援するキャリア展開 | ||
| 石橋 寿子 | (小野薬品工業株式会社 クリニカルオペレーション一部 第一課) | |
近年、CRCを取り巻く環境は大きく変化しており、求められる役割が幅広くなり、CRCのキャリアUPも多様化している。
あなたの理想のCRC像は? 将来の自分の姿をイメージできていますか?
キャリアは、次のような過程を繰り返すことで形成されていくと考える。①これまでの経験や実績を振り返り、自己の価値観やビジョンを取捨選択し将来像をイメージする。②将来像と現在の自分に不足していることや必要なことを見極め、キャリアプランを立案する。③プランに沿って実績を積む。
将来像やキャリアプランは、経験や周囲の影響等により変化する可能性もあるため、時に立ち止って見直し、修正も必要となる。また、個人の成長は組織の向上にもつながることから、個人のビジョンだけでなく、組織の中で求められる役割も考え行動する必要がある。
マネジメントの面からみると、CRCは多種多様な経歴とライセンスを持ち、キャリアに対する価値観も異なるスタッフが多いと予測され、管理者には各々のスタッフに適切な動機付けをし、個人と組織の成長のためにもキャリアUPの支援をしていく必要がある。
一般的に組織内での地位向上や転職等として使われているキャリアUPだけではなく、目標や目的を持ちCRCとして経験と研鑽を重ねて成長することもキャリアUPであることから、本シンポジウムはテーマを意図的に「キャリアUP」と表現している。
①CRCとしてキャリアUPされてきた経験より、②スタッフのキャリアUPを支援された経験より、③CRCからキャリアチェンジし、CRCの経験を活かした現在の活動について、それぞれお話しいただく。
今は目標やビジョンが明確に定まっていなくても、ふと立ち止まりキャリアUPを意識することで、これから10年、20年、さらにその先の可能性を広げる機会となればと考える。
シンポジウム 11
9月15日(日) 8:40~10:10
第5会場
CRCのマネジメント力
~症例登録遅延や人手不足などを解決するお役立てツール~
| 座長: | 菊地 佳代子 | (国立成育医療研究センター/慶應義塾大学臨床研究センター) |
| 演者: | プロジェクトマネジメントの手始め | |
| 佐藤 隆 | (協和キリン株式会社 研究開発企画部) | |
| 症例登録の工夫 ~クリニックと病院~ | ||
| 三宅 こず恵 | (国立成育医療研究センター 臨床研究センター 開発推進部 臨床試験推進室) | |
| 人手不足をマネジメント ~やってやれないコトはない?! ~ | ||
| 山路 直美 | (独立行政法人国立病院機構 福山医療センター) | |
| うまくいっていることの中に、うまくいく原理を発見する方法 | ||
| 今野 浩一 | (PMコンサルティング ポジティブ・インテンション) | |
あの人が担当する臨床試験はなぜ、うまくいっているのだろうか。なぜ、自分の成功例を話しても後輩は同じように行動できないのか。なぜ、この前の試験はうまくいったのに、今回はこんなに問題だらけなのか。目の前にある試験をうまく進めるためにはどのようなアプローチを取ればいいのか。
本セッションでは、CRCなら一度は直面すると思われる症例登録遅延や人手不足などのお困りごとについて、解決に導いた事例や解決に至らなかった事例を各演者から紹介し、その結果につながった何気ない行動にプロジェクトマネジメント知識体系に基づいた解説をほどこすことで"見える化"し、さらに、参加者が明日の臨床試験に役立つスケジュール管理、リスク分析、コミュニケーションに対するお役立ちツールを共有する。
当日は"プロジェクトマネジメント"の基本知識を解説した後、参加者、演者、座長とのインタラクティブなやり取りをしながら、演者だけでなく、参加者の方々の成功体験と失敗体験も"見える化"したい。 そして、その"見える化"した成功のポイントとお役立ちツールを参加者が自施設にて共有することで、日々の業務改善や後輩や部下の教育方法の改善につながることを期待している。
本セッションの解説はプロジェクトマネジメントツールや手法に視点を置く。CRC業務で同じように大切なコミュニケーションを中心とする調整力については『まわりの人が協力的に動いてくれる?CRCの調整力』、CRAとのコミュニケーションについては『CRCとCRAの対話の部屋』にて取り扱うので、あわせて参加いただきたい。
シンポジウム 12
9月15日(日) 10:20~11:50
第5会場
まわりの人が協力的に動いてくれる?CRCの調整力
~院内外のコーディネーションのアイデア~
| 座長: | 藤原 紀子 | (東京大学医科学研究所附属病院 緩和医療科/TR・治験センター) |
| 佐藤 隆 | (協和キリン株式会社 研究開発企画部) | |
| 演者: | 互いが気持ちよく協働できる関係を目指して | |
| 柳澤 由紀 | (静岡県立静岡がんセンター 治験管理室) | |
| 臨床看護師とCRCのコミュニケーション | ||
| 玉木 秀子 | (埼玉医科大学国際医療センター 通院治療センター) | |
| 背中の預け方 ~治験事務局の本音からコミュニケーションを考える~ | ||
| 長谷山 貴博 | (信州大学医学部附属病院 臨床研究支援センター) | |
| 協働する上で大切にしていること ~製薬企業,CRAの立場から~ | ||
| 山内 美代子 | (株式会社中外臨床研究センター) | |
臨床試験に関わる人(職種)はどんどん増えているものの、特に看護部、薬剤部、検査部などの臨床部門や、事務局との院内調整、そして院外では製薬企業のモニターさんやCRO、SMOの人たちの間に入ってコーディネートするときに、困ったなぁと思うことはありませんか?部門間の連携会議、SOP、ITを駆使した情報共有方法など、いろいろなハード面でのツールや仕組みを駆使しても、ここぞというときになんだか協力が得られなくて苦労した、試験が進まなかった・・・と状況は、CRCなら誰もが一度は経験しているのではないでしょうか。
結局は「人」。人とひととのつながり・協働で臨床試験は成り立っています。国際共同試験だけでなく、国内試験においても、様々な職種間の連携や・立場の違いなど、異文化交流のスキルが求められています。
本セッションでは、院内外の調整の要となるCRC、臨床部門においてCRCと連携をしている看護師、CRCと日々連携している事務局の方、そして、院外連携として製薬企業の方に演者としてご参加いただき、「私たちも日々苦労することがありますよ~」でも、「こんな小さな工夫が成功した!」「私たちの立場からは連携についてこんな案が出せるかも」といった具体的な現場の話題を共有いただきます。また、本セッションに参加してくださる方々と、演者とのディスカッション時間をたっぷりと儲け、座長がファシリテートしながら多くの方から、明日に役立つ院内外の調整のアイデアをいただき共有したいと思います。
人とひととをつなぐというロマンのあるCRCの仕事、本来のコーディネーションのスキルを一緒に考えてみませんか?
多職種で働くときのハードスキルであるツールやシステムなどは、「CRCのマネジメント力」で学べます。本セッションは、ツールやシステムを上手く活用するために、人間関係のスキルやチームビルディングなどの手法に視点を置いています。また、CRAとCRCのコミュニケーションにフォーカスしたセッションについては、「CRCとCRAの対話の部屋」が開催されますので、ぜひご参加ください。
シンポジウム 13
9月15日(日) 13:20~14:50
第2会場
がんゲノム診療 ~いよいよゲノム情報に基づくがん医療が保険診療に~
| 座長: | 老本 名津子 | (京都大学医学部附属病院 臨床研究総合センター 治験管理部) |
| 若林 薫 | (東京都済生会中央病院 臨床研究センター) | |
| 演者: | がんゲノム医療の提供体制について | |
| 上野 秀樹 | (国立研究開発法人国立がん研究センター中央病院 臨床研究支援部門) | |
| エキスパートパネルとがんゲノム医療の実装化 ~現状と今後の課題~ | ||
| 清水 俊雄 | (国立研究開発法人国立がん研究センター中央病院 先端医療科) | |
| 患者申出療養の制度を活用した受け皿試験 | ||
| 下井 辰徳 | (国立研究開発法人国立がん研究センター 中央病院) | |
| がんゲノム診療におけるCRCの役割を考える | ||
| 土屋 美枝 | (公立大学法人横浜市立大学附属病院 次世代臨床研究センター 臨床試験管理室) | |
2018年12月末に、2つの網羅的遺伝子検査システム(「OncoGuideTM NCCオンコパネルシステム」および「FoundationOne® CDxがんゲノムプロファイル」 )が薬事承認され、本年5月末の中医協総会で保険収載とその価格が決定した。
昨年2月に厚生労働省により指定された「がんゲノム医療中核拠点病院」を中心に、これらの検査はなされ、国民皆保険制度下でがんゲノム情報に基づく診療が始まる今、CRCとしてもゲノム医療に関する基本的知識の習得が求められている。
さらに、これら網羅的遺伝子検査システムの結果、効果が期待できる抗がん剤が見つかったものの参加可能な治験等が無い患者さんにおいては、抗がん剤の適応外使用を患者申出療養の枠組みで実施する準備が進められており、CRCは、この患者申出療養への対応を求められる可能性がある。
本シンポジウムでは、がんゲノム情報に基づく臨床試験および患者申出療養制度を活用して行われる臨床試験についての理解を深める機会としたい。また、遺伝子検査を伴う臨床試験の支援において、CRCが同意説明補助を行う際に配慮すべき点等、がんゲノム医療の特徴を理解した支援を学ぶ機会となることを期待している。
シンポジウム 14
9月15日(日) 13:20~14:50
第3会場
再生医療等製品の治験 ~基本を知って備えよう~
| 座長: | 岡田 潔 | (大阪大学大学院医学系研究科) |
| 森尾 友宏 | (東京医科歯科大学大学院 発生発達病態分野) | |
| 演者: | 再生医療等製品の臨床研究と治験の現状と課題 | |
| 岡田 潔 | (大阪大学大学院医学系研究科) | |
| 再生医療等治験を実施する際の施設プロセスとCRCの役割 | ||
| 佐々木 由紀 | (北海道大学病院 臨床研究開発センター) | |
| 社会とともに再生医療を実現化させるためには何が必要か | ||
| 八代 嘉美 | (神奈川県立保健福祉大学 イノベーション政策研究センター) | |
| 再生医療等製品の治験の実例と課題 | ||
| 井家 益和 | (株式会社ジャパン・ティッシュ・エンジニアリング) | |
近年、再生医療等製品の開発が急速に進んでいます。平成25年に薬事法から医薬品医療機器等法に改正され、再生医療等製品が医薬品、医療機器と別の技術として位置づけられたこと、さらに同時期に「条件及び期限付き承認」という新たな制度が整備されたことで、国内では再生医療等製品の開発が一気に活気づきました。現在、国内で承認されている再生医療等製品は9製品、うち7製品が医薬品医療機器等法へ改正後に承認され、うち3製品が「条件及び期限付き承認」に該当します。
しかし、一般に再生医療等製品の治験は小規模で限定された施設でしか行われません。承認された製品も、ほとんどの国内治験が単独または数施設で行われ症例数も数例程度とごく小規模なもので、再生医療等製品の治験や承認がニュースになる割には、CRCとして治験に関わった人はまだまだ少数と思います。そのため、再生医療等製品の治験が医薬品や医療機器の治験とどんなところが違うのか、特に注意すべき点はあるのか、あるとすればどういうことなのかなど、具体的な知識が普及しているとはいえません。今回のシンポジウムでは、再生医療等製品の開発に関わる医師、CRC、企業、研究倫理の専門家という4名の演者から、開発の現状、治験の特徴や実施上の注意点、倫理的側面などを語って頂き、再生医療等製品の治験に関する基本的かつ実際的な知識を参加者全員で共有し深める場としたいと思います。主な対象を再生医療等製品の治験の未経験者に設定していますので、どんなレベルの方でも気軽に参加できるシンポジウムです。
ワークショップ
ワークショップ 1
9月14日(土) 10:00~11:30
第5会場
CRC働き方座談会 ~課題は何か?私たちに何ができるか?~
| オーガナイザー: | 長谷山 貴博 | (信州大学医学部附属病院 臨床研究支援センター) |
| 山本 明子 | (学校法人北里研究所 北里大学病院 臨床試験センター) | |
| 森本 陽子 | (メディデータ・ソリューションズ株式会社 GCS部門) | |
| パネラー: | 小林 久子 | (大阪大学医学部附属病院 未来医療開発部 臨床研究センター) |
| 鳥口 尚子 | (神戸大学医学部附属病院 臨床研究推進センター) | |
| 加藤 みどり | (サイトサポート・インスティテュート株式会社 人財育成・コンプライアンス本部 人財育成研修部) | |
| 後藤 美穂 | (トライアドジャパン株式会社 新薬開発支援部) | |
| 河田 慎平 | (秋田県立循環器・脳脊髄センター 研究推進室) |
1997年の省令GCP施行を受け、適正な治験を円滑に実施するために、「CRC」という職種が生まれた。誕生から20年が経過した現在でも、治験を始めとした臨床研究の実施にCRCが必要不可欠な存在であることに変わりはなく、これからも維持・発展されていくべき職能である。その一方で、決して楽ではない職業環境にさらされ続けており、道半ばで心折れる人も少なくない。世間では「働き方改革」が叫ばれる中、CRCの働き方においては「どのような課題があるか」「私たちに何かできるか」、座談会形式で話し合う場を企画した。
本企画を実施するにあたり、事前に「CRCの働き方に関するアンケート」を行う。会場ではこの結果をもとに、参加者の皆様を含めた全員で話し合う。ただ不満を集めるようなネガティブな会ではなく、課題を明確化・共有し、実際にできていること・やろうとしていることを持ち寄り、参加者全員が『明日からできる小さな一歩』を見つけるポジティブな会にしたい。
パネラーには、多種多様な経歴・活動をしているCRC及びCRC経験者をアサインした。CRCの実態調査、啓発活動、働き方改革の実際、海外の実施施設、パラレルワーク、パラレルキャリア、教育からの目線など(現時点での予定)、パネラーよりバラエティに富んだ情報提供を受けつつ、様々な切り口から話し合いを展開したい。
もし、あなたが自身の働き方について、「自分に出来ることはない」「何もしていない」と考えているならば、ぜひ本企画にご参加いただきたい。また、本企画はCRCの働き方に主軸を置くが、CRC以外の方の参加も歓迎する。座談会形式や事前アンケートの他にも、たくさんの仕掛けを用意している。皆様にとって、実りある座談会となれば幸いである。
事前アンケートを終了いたしました。ご協力ありがとうございました。
ワークショップ 2
事前参加登録制
9月14日(土) 14:40~16:40
第5会場
【臨床試験支援財団主催】 話し合う:効果的な対話のために!
| ファシリテーター: | 中野 重行 | (大分大学 名誉教授/創薬育薬医療コミュニケーション協会) |
創薬育薬医療の領域における質の高いパフォーマンスを追求する際には、幅広い範囲にいろいろな仕事をしているプレイヤーが働いていることを特徴の一つとする「創薬育薬医療チーム」の存在を意識することが役立ちます。「創薬育薬医療チーム」としてのよきチームプレイが、質の高いパフォーマンスを達成するためには決定的に重要になるからです。よい「チームプレイ」が生まれるためには、チームプレイヤー相互の間、あるいは、患者との間での「よきコミュニケーション」が必須となります。
「コミュニケーションは双方の情報を共有するプロセスである」と理解すると、私たちのすべきことが分かりやすくなります。この参加体験型ワークショップ(WS)は、『よきコミュニケーション』のイメージを頭に描き、そのために必要なスキルを身につけるために行います。今回のテーマは『話し合う』です。私たちは誰かと「話し合う」とき、目的に応じて話す内容を考え、相手の反応を見て感情の動きを読み取ることが必要になります。平素は無意識のうちに行っている「話し合い」という行為について、そのプロセスを意識して体験してみます。
話す際の「話」を「内容」と「文脈」(あるいは「態度」)に分けてとらえてみます。話す際の「内容」を目の前で起こった客観的「事実」と、そのとき自分の中に生まれる主観的な「心の動き」(感情と思考)に分けて整理します。そのうえで、情報を共有する際に役立つコンセプトである『やわらかな1.5人称』の姿勢で話し合うというワークを体験します。限られた時間内ではありますが、「話し合う」プロセスを構造的に理解し、効果的な話し合いに必要なポイントを学びます。
2017年の「聴く」、2018年の「伝える」に続くWSですが、初めて参加される方も大歓迎です。
ワークショップ 3
事前参加登録制
9月15日(日) 13:20~14:50
第5会場
CRCとCRAの対話の部屋
| ファシリテーター: | 今野 浩一 | (PMコンサルティング ポジティブ・インテンション) |
| 吉田 則子 | (プロジェクト・カウンセリング・オフィス cocokara) |
CRCとCRA。あなたにとってどんな関係性が理想ですか?
同じゴールに向かいながらも、それぞれのやりたいこと、なりたい姿も実現できる、それを応援し合える仲間がいたら、心からわくわくしませんか?
ひとつの試験がきっかけにして、お互いに強いつながりを感じ、心から尊重しあえる仲間ができたら、毎日が感謝の気持ちでいっぱいになりませんか?
不安なこともあるけれど、正直に打ち明け相談し、助け合って乗り越えられる。そんな頼りになる仲間がいたら、一歩前に出てみようかなと思いませんか?
たくさんの制約がある中でも、自分が本当にやりたいことを自分で決めていいよと応援してくれる。そんな仲間がいたら、自分は大切な存在なんだとあらためて思えるでしょう。
もし、目の前にいる人が、そんな仲間になってくれるかもしれないと思ったら、あなたは何をしたいですか?
CRCとCRA。それぞれが自身の立場・役割を真剣に果たそうとすればするほど、その人が誠実な人であればあるほど、対立はふつうに起こります。起こらない方が不自然なのです。共にその気持ちの根底にあるのは、「与えられた役割をしっかりと果たして臨床試験に貢献したい!」という想いではないでしょうか?
本セッションでは、CRC、CRAのそれぞれの立場を紹介してもらい、その場で生まれた「話したい!テーマ」について参加者全員で対話をしてみたいと思います。
それぞれの役割について、「ここはわかって欲しい!」ということについては「なぜそうしたいのか?なぜ、そう思うのか?」をしっかり話してほしいのです。また、「どうして?そこがわからない!」と思うことについては「なぜそうなっているのか?それをどう感じているのか?」をしっかり聴いてほしいのです。
そして、本セッションが終わった時には、たくさんの仲間といっしょにこの部屋を後にしていただきたいと思っています!
市民公開講座
9月15日(日) 13:20~14:50
第4会場
患者・家族向け公開セミナー
~臨床試験、臨床研究、治験について知ろう~
| 座長: | 鶴丸 雅子 | (長崎大学病院 臨床研究センター) |
| 西村 由希子 | (特定非営利活動法人Asrid) | |
| 演者: | イントロダクション ―患者視点でみた臨床試験(治験)とは― | |
| 西村 由希子 | (特定非営利活動法人ASrid) | |
| “新しい医療”を生み出すために | ||
| 後澤 乃扶子 | (国立がん研究センター研究支援センター 研究管理部) | |
| 医薬品開発の新しいパラダイム | ||
| 森 和彦 | (厚生労働省) | |
| 臨床試験実施者と患者・家族との橋渡し ―CRCという職業について― | ||
| 鈴木 由加利 | (新潟大学医歯学総合病院 臨床研究推進センター) | |
共催セミナー
共催セミナー1
9月14日(土) 11:50~12:50
第1会場
臨床研究を取り巻く後ろ向き調査データ利用の現状と変化
| 座長: | 丸山 由起子 | (公益社団法人日本医師会 治験促進センター) |
| 演者: | 水島 洋 | (国立保健医療科学院 研究情報支援研究センター) |
共催:公益社団法人日本医師会 治験促進センター
共催セミナー2
9月14日(土) 11:50~13:20
第2会場
おさえておきたい治験英語
| 座長: | 小川 武則 | (一般社団法人日本CRO協会) |
| 演者: | 木次 佳太 | (サン・フレア アカデミー) |
共催:一般社団法人日本CRO協会/サン・フレア アカデミー
共催セミナー3
9月14日(土) 11:50~12:50
第3会場
私が臨床試験に参加しなかった本当の理由
~年間3万人の臨床試験参加者を支える、ボランティアDBへのアンケートより~
| 座長: | 熊谷 雄治 | (学校法人北里研究所 北里大学医学部附属臨床研究センター) |
| 演者: | 牧 大輔 | (日本PRO協会/3Hホールディングス株式会社3Hライフサイエンス研究所) |
共催:日本PRO協会
共催セミナー4
9月14日(土) 11:50~12:50
第4会場
日本がグローバル試験から排除される日 ~わたしたちが今日からできること~
| 座長: | 平島 亜希子 | (欧州製薬団体連合会 臨床部会/アストラゼネカ株式会社) |
| 髙橋 英司 | (米国研究製薬工業協会 臨床部会/アッヴィ合同会社) | |
| 演者: | 実施医療機関における症例集積に対する取り組みの現状と向上のために必要なこと ~アンケート結果から~ |
|
| 李 淳馨 | (アッヴィ合同会社) | |
本セッションへの皆さまのご参加がより有意義になりますように、セッションテーマに関する皆さまの声をお聞かせいただきたいと思いますので、アンケートにご協力くださいますようよろしくお願いいたします。
共催:PhRMA/EFPIA Japan
共催セミナー5
9月14日(土) 11:50~12:50
第6会場
CRCから見た患者中心の臨床試験 ~実践的最前線~
| 座長: | 池田 律子 | (滋賀医科大学医学部附属病院 臨床研究開発センター) |
| 演者: | 吉井 時秋 | (パレクセル・インターナショナル株式会社 グローバルサイトソリューションズ部) |
共催:パレクセル・インターナショナル株式会社
共催セミナー6
9月15日(日) 11:40~13:00
第1会場
皆さんと一緒に考えたいPatient Engagement
~TransCelerateの立場から~
| 座長: | 大司 照彦 | (塩野義製薬株式会社) |
| 鈴木 智也 | (メルクバイオファーマ株式会社) | |
| 演者: | 患者さん目線での臨床試験への取り組み | |
| 堀井 智子 | (日本イーライリリー株式会社) | |
| 北村 篤嗣 | (ファイザーR&D合同会社) | |
| パネラー: | 田崎 史哲 | (患者代表 学生) |
| 小牧 宏文 | (国立研究開発法人国立精神・神経医療研究センター トランスレーショナル・メディカルセンター) | |
| 太幡 真紀 | (国立研究開発法人国立精神・神経医療研究センター 臨床研究推進部) | |
| 北村 篤嗣 | (ファイザーR&D合同会社) | |
| 堀井 智子 | (日本イーライリリー株式会社) | |
| 演者: | TransCelerateでのPharmacovigilance活動の紹介 | |
| 橋本 雅実 | (サノフィ株式会社) | |
共催:TransCelerate
共催セミナー7
9月15日(日) 12:00~13:00
第2会場
精神科治療薬の臨床試験について
| 座長: | 古郡 規雄 | (獨協医科大学 精神神経医学講座/第40回日本臨床薬理学会学術総会 事務局長) |
| 演者: | 下田 和孝 | (獨協医科大学 精神神経医学講座/第40回日本臨床薬理学会学術総会 会長/日本臨床薬理学会 理事長) |
共催:第40回日本臨床薬理学会学術総会
共催セミナー8
9月15日(日) 12:00~13:00
第3会場
監査の人は「付箋」まで残せって言うのはどうして?
| 座長: | 渡辺 俊彦 | (Meiji Seika ファルマ株式会社 薬事監査室) |
| 演者: | 中村 宏治 | (北海道大学病院 臨床研究開発センター 信頼性保証部門 監査室) |
| 下向 東紅 | (ACメディカル株式会社 信頼性保証部) |
共催:一般社団法人日本QA研究会
共催セミナー9
9月15日(日) 12:00~13:00
第4会場
SMOによる治療実施医療機関の品質管理支援
~プロセス管理の取り組み~
| 座長: | 塚原 英樹 | (日本SMO協会/株式会社アルメック) |
| 松島 学 | (日本SMO協会/インクロム株式会社) | |
| 演者: | 治療業務プロセスの可視化 ~医療機関リスクベースドQMS構築を目指して~ | |
| 相原 啓乃 | (日本SMO協会/株式会社アイロム) | |
| SMO支援医療機関におけるRisk Based Approach (RBA) ~Risk Based Monitoring (RBM) 実装のためのステップ~ |
||
| 阿部 朝美 | (日本SMO協会/サイトサポート・インスティテュート株式会社) | |
| 治験実施医療機関におけるRisk Based Approachを通じたBuilt - in Quality | ||
| 永島 香織 | (日本SMO協会/株式会社アルメック) | |
共催:日本SMO協会

