プログラム
事後のスライド掲載について
各セッションの講演スライド(公開可能なもの)を、2021年1月31日(日)まで掲載いたします。
閲覧用のIDとパスワードは、プログラム・抄録集の11ページ「9.事後スライド掲載」箇所に記載しております。
著作権区分(A/B)をご確認のうえ、節度あるご利用をお願いします。
タイムテーブルのセッション名をクリックするとセッション概要をご覧いただけます
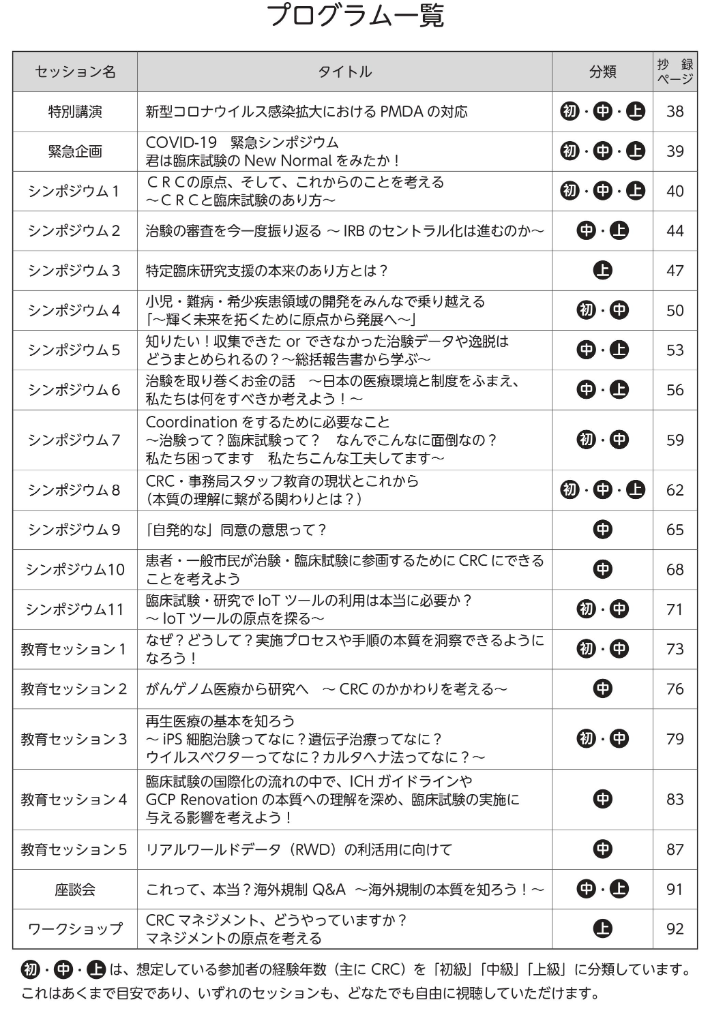
特別講演初・中・上
新型コロナウイルス感染拡大におけるPMDAの対応
- 座長
- 鶴丸 雅子(長崎大学病院 臨床研究センター/薬剤部)
- 演者
- 藤原 康弘(独立行政法人 医薬品医療機器総合機構 理事長)
緊急企画初・中・上
COVID-19 緊急シンポジウム 君は臨床試験のNew Normalをみたか!
- 座長
- 後澤 乃扶子(国立がん研究センター 研究支援センター 研究管理部研究管理課)
- 中村 治雅(国立精神・神経医療研究センター トランスレーショナルメディカルセンター
臨床研究支援部) - 演者
- 第20回CRCと臨床試験のあり方を考える会議 2020 in長崎
会議代表・プログラム委員全員
シンポジウム1初・中・上
CRCの原点、そして、これからのことを考える ~CRCと臨床試験のあり方~
- 座長
- 稲田 実枝子(北九州市立病院機構 北九州市立医療センター 臨床研究推進室)
- 森下 典子(国立病院機構本部 総合研究センター 治験研究部治験推進室)
- 演者
- SY1-1 CRCの軌跡、CRCの将来像 森下 典子(国立病院機構本部 総合研究センター 治験研究部治験推進室)
- SY1-2 「CRCあり方会議」と共に20年、今、CRCについて考えること 鈴木 千恵子(浜松医科大学医学部附属病院 臨床研究センター)
- SY1-3 医師の立場からみたCRCのこれまでとこれから 山本 晴子(国立循環器病研究センター 臨床研究管理部)
- SY1-4 SMOのCRCの軌跡、これからの役割期待および役割行動 三嶽 秋久(シミックヘルスケア・インスティテュート株式会社)
- SY1-5 治験を取り巻く環境とCRCとして大切にしていること 河野 直美(熊本大学病院 総合臨床研究部 臨床試験支援センター)
- SY1-6 現役CRCが進むべき道とは 坂口 裕美(九州大学病院 ARO次世代医療センター)
今年、本会議は第20回という記念すべき節目を迎える。そこで、本会議のテーマである「本質を考える~ 輝く未来を拓く原点~」に基づき原点にもどり、改めてこれからのCRCと臨床試験のあり方を考えるシンポ ジウムを企画した。
シンポジストには、日本のCRCを牽引してこられた方、治験・臨床研究を実施している医師、SMOにおいてCRCのあり方を考えマネジメントしておられる方、これからの時代を担うCRCをお迎えし、それぞれの立場からご発表いただく。
このセッションに参加した方が、改めてCRCと本会議の原点を知り、そして、これからのCRCが進む道、担っていく役割、CRCが目指すCRC像、本会議のあり方を自ら考える機会となることを期待する。なお、第8回会議(2008年金沢開催)の報告書に本会議について以下のように記されていたので紹介する。是非ご一読いただきたい。
(神谷晃先生(第20回会議運営委員会委員長)の手記より抜粋)
・この会議のタイトルには「CRCが自らのあり方を自ら考える」という願いが込められている
・学会のようにピラミッドの頂上付近の人たちが考えた方向を目指すのではなく、臨床試験に係わるみんなが 知恵を出し合って、新しい方向を作り出してゆこうという会である
・特にCRCが一人前になるまでの間は、みんなで支えあいながら進もうとして始まった会である
・「問題は現場で起こっている」ことを忘れず、その解決に取り組もうとした会である
シンポジウム2中・上
治験の審査を今一度振り返る ~IRBのセントラル化は進むのか~
- 座長
- 栗山 猛(国立成育医療研究センター 臨床研究センター 多施設連携部門)
- 中西 洋一(北九州市立病院機構/特定非営利活動法人治験ネットワーク福岡)
- 演者
- SY2-1 中央審査の経験と効率的な活用方法 武井 順平(国立成育医療研究センター 臨床研究センター ネットワーク推進ユニット)
- SY2-2 共同IRBの立場から これまでの経験と課題 中西 洋一(北九州市立病院機構/特定非営利活動法人治験ネットワーク福岡)
- SY2-3 C-IRBの活用~福島県立医科大学附属病院とACTIVATO/TTN 稲野 彰洋(福島県立医科大学附属病院 臨床研究センター)
- SY2-4 治験審査のセントラル化について ~治験依頼者の立場から~ 青柳 充顕(日本製薬工業協会 医薬品評価委員会・臨床評価部会/エーザイ株式会社)
GCP省令が施行された当時、医療機関ごとのIRB設置が原則であった。その後、平成20年3月のGCP省令改正により、その原則が廃止され、共同IRBやセントラルIRB(以下、C-IRB)の利用が可能になったが、十分な普及につながっていない。
一方で、治験以外の研究審査は臨床研究法施行により特定臨床研究の研究審査はCRBでの中央審査となった。観察研究においても中央審査の議論が進んでいる。
CRBによる研究審査で得た経験は、治験の審査へ生かせることができるポイントは何か、C-IRBの利用が進まない問題が何かを各自が知ることから始めることが必要である。
本シンポジウムではもう一度研究の審査のあり方の“原点”に戻り、その本質は何かを振り返り、治験の中央審査について議論を行いたい。
シンポジウム3上
特定臨床研究支援の本来のあり方とは?
- 座長
- 丸本 芳雄(山口大学医学部附属病院 臨床研究センター)
- 平瀬 佳苗(国立循環器病研究センター 臨床研究推進センター 臨床研究管理部CRC室)
- 演者
- SY3-1 特定臨床研究、何が大変???(医師の立場から) 大坪 孝平(北九州市立医療センター 呼吸器内科)
- SY3-2 認定臨床研究審査委員会事務局の立場から
~委員会事務局の現状と研究者への支援について~ 吉岡 まみ(東京都健康長寿医療センター 健康長寿イノベーションセンター) - SY3-3 「モニタリング支援、やっとここまで来た。」
- CRCしながらモニターへ - 古屋 由加(広島大学病院 広島臨床研究開発支援センター 臨床研究・計画実施支援部門/モニタリング室) - SY3-4 特定臨床研究、どう支援するか?
-共同研究施設のCRC・治験・臨床研究事務局の立場から- 後藤 千佳子(鹿児島市立病院 臨床研究支援センター 治験・臨床研究管理室)
臨床研究に関連する法的規則は、従来の治験が対象となる医薬品医療機器等法及やGCP等に加え、平成30年4月より、特定臨床研究(未承認・適応外の医薬品等の臨床研究及び、製薬企業等から資金提供を受けた医薬品等の臨床研究)が対象となる臨床研究法が加わった。
臨床研究法下で実施する特定臨床研究では、認定臨床研究審査委員会(以下CRB)への申請や、実施施設管理者の実施許可取得、利益相反管理、国への各種届出や報告、文書保管等、様々な業務を研究責任医師の責任の下で実施しなければならず、違反した場合は罰金刑が課せられる場合もある。
このような状況下で適切に特定臨床研究を実施するため、研究責任医師から院内の臨床研究支援部門に支援を求められても、リソースが少ない特定臨床研究では治験と同様のCRC支援の実施は困難であり、費用対効果を踏まえた支援のあり方を検討する必要がある。また、治験でCRC業務を実施している者が、特定臨床研究の各種申請支援やモニター業務を行う場合もあり、カバーしなければならない業務範囲も広がっている。
本セッションでは、実際に特定臨床研究を実施している医師、CRB及び治験・臨床研究事務局、CRC、モニターの立場から、実情を踏まえた適切な臨床研究実施のための支援のあり方について議論する。
シンポジウム4初・中
小児・難病・希少疾患領域の開発をみんなで乗り越える
「~輝く未来を拓くために原点から発展へ~」
- 座長
- 栗山 猛(国立成育医療研究センター 臨床研究センター 多施設連携部門)
- 中村 治雅(国立精神・神経医療研究センター トランスレーショナルメディカルセンター
臨床研究支援部) - 演者
- SY4-1 小児領域における開発推進に向けた取り組み 栗山 猛(国立成育医療研究センター 臨床研究センター 多施設連携部門)
- SY4-2 神経難病での開発促進に向けた取り組み
中村 治雅(国立精神・神経医療研究センター トランスレーショナルメディカルセンター
臨床研究支援部) - SY4-3 東大病院での小児治験におけるCRCとしての経験 平田 えりか(東京大学医学部附属病院 臨床研究推進センター)
- SY4-4 難病領域の臨床開発におけるCRCとしての経験と取り組み 原田 裕子(国立精神・神経医療研究センター 臨床研究推進部)
小児疾病や難病等における医薬品・医療機器等の開発については、採算性や対象患者数が少ないこと臨床試験の実施に配慮が必要なことなどから他の領域と比較してなかなか進まない領域とされています。今般、医薬品医療機器等法の改正により、小児や難病領域における医薬品等開発を促進する制度も盛り込まれるとともに「臨床研究・治験の推進に関する今後の方向性について2019年版とりまとめ」においても国として、当該領域への重点的取組みが必要とされています。さらには、当該領域を担う臨床研究中核病院のあり方も議論されているなど、小児疾病や難病等における医薬品開発推進のための新たな活動が模索されているところです。本シンポジウムでは、これら背景を踏まえ、小児疾病や難病等における研究開発推進のための制度についてご紹介いただくとともに、CRCの活動や今後の展開、患者家族との関わりなどを通して、医薬品開発の一翼を担うCRCが未来を拓き発展していくために何をすべきかを原点から考える有用な議論の場としたいと思います。
小児・難病領域での医薬品等の開発推進には、医療現場と企業そして国が連携して取り組んでいくことが重要です。その中でCRC自身がどのようにモチベーションを維持し発展していく必要があるのか考えていければ幸いです。
未来を担う子どもたちや難病を抱える患者さんたちの幸せのために、我々が一丸となって乗り越えて行きましょう!!
シンポジウム5中・上
知りたい!収集できた or できなかった治験データや逸脱はどうまとめられるの?~総括報告書から学ぶ~
- 座長
- 松嶋 由紀子(慶應義塾大学病院 臨床研究推進センター 臨床研究企画推進部門企画推進ユニット/
臨床研究支援部門モニタリングユニット) - 山﨑 純子(神戸大学医学部附属病院 臨床研究推進センター)
- 演者
- SY5-1 総論:総括報告書の全体像と逸脱情報の取り扱い 熊倉 智彦(第一三共株式会社 開発薬事部メディカルライティンググループ)
- SY5-2 臨床試験におけるデータマネジメントや統計部門の役割 山口 拓洋(東北大学大学院医学系研究科医学統計学分野/東北大学病院 臨床試験データセンター)
- SY5-3 臨床試験の欠測データの取り扱いに関する
最近の展開と今後の課題について 菅波 秀規(興和株式会社 臨床解析部) - SY5-4 規制当局の立場からCRCへメッセージ:データ収集のあり方 中山 貴夫(医薬品医療機器総合機構 信頼性保証部)
治験で収集された被験者のデータは、データセットにまとめられた後、統計解析等が実施され、総括報告書(CSR)にまとめられる。CSRは承認申請資料として提出されるとともに、添付文書にも反映される。
CRCやCRAは、合併症、既往歴、治療歴、規定検査データ、有害事象、併用薬と非常に幅広いデータ収集に関与し、可能な限り逸脱・欠測の発生防止に務めているが、収集したデータが最終的にどのような形で活用されるか意識をして業務を行っているだろうか?
また、日常業務で屡々発生する『逸脱や欠測値』については、『逸脱・欠測=ミス(絶対にしてはいけない)』と杓子定規に理解し、それを防ぐため、被験者に追加で無理な手順等を強いていることはないだろうか?
本セッションでは、逸脱・欠測も含め、治験で得られたデータが、どのように取り扱われ、「総括報告書」としてまとめられるのか共有する。現場で収集されたデータが、最終的にはどのような形で承認申請に使用されるのかを知ることで、日々の業務を振り返り臨床試験チームが協働することの重要性について理解が深まるようなセッションとしたい。データの行方を知り、その意義や本質を一緒に考えてみませんか。
シンポジウム6中・上
治験を取り巻くお金の話
~日本の医療環境と制度をふまえ、私たちは何をすべきか考えよう!~
- 座長
- 久米 学(神戸大学医学部附属病院 臨床研究推進センター/薬剤部)
- 黒田 智(岡山大学病院 新医療研究開発センター治験推進部/薬剤部)
- 演者
- SY6-1 日本の医療を取り巻く現状と課題 黒田 智(岡山大学病院 新医療研究開発センター治験推進部/薬剤部)
- SY6-2 被験者負担軽減費と治験診療に対する治験依頼者の
費用負担の見直しについて 近藤 直樹(国立国際医療研究センター病院 薬剤部) - SY6-3 我が国における適正な治験費用の実現に向けて
〜Fair Market Valueの概念に基づいた治験費用算定プロセス〜 藤岡 慶壮(日本製薬工業協会 医薬品評価委員会 臨床評価部会/大日本住友製薬株式会社)
わが国は少子高齢化社会を迎え、昨今の医療を取り巻く環境は大きく変化している。皆保険制度を維持するためには、高齢者を現役世代で支えていく必要があり、現状では先行きが明るいとは言えない。
さて、皆保険制度に関して、治験は主に2つの点で関わっている。1つは治験実施中の患者に対しては保険外併用療養費制度によりいわゆる混合診療が認められ、保険を部分的に使用することができる点である。もう1つは、類似薬がないような医薬品等が承認された場合は、原価計算方式により治験等にかかった実費用を元に薬価が算定され、将来の患者がその薬価で保険を使って医療を受ける点である。なお、原価計算方式では治験に係る医療費だけではなく、モニタリングや医療機関への研究費、負担軽減費等の費用も考慮されるため、治験にかかる余分な業務・費用を抑えることと、適正な費用設定とすることも重要である。
このシンポジウムでは、まず日本の医療の現状を説明いただき、さらに医療機関、治験依頼者よりそれぞれ治験の費用に関する取り組み例を紹介していただく。そのうえで、治験に係る費用の問題について我々が今何をすべきか考えたい。
シンポジウム7初・中
Coordinationをするために必要なこと ~治験って?臨床試験って?
なんでこんなに面倒なの? 私たち困ってます 私たちこんな工夫してます~
- 座長
- 藤原 紀子(東京大学医科学研究所附属病院 緩和医療科)
- 豊田 宜子(浜松医科大学医学部附属病院 臨床研究センター)
- 演者
- SY7-1 薬剤師の立場から、治験で困ったことと対応 樋口 則英(長崎みなとメディカルセンター 薬剤部)
- SY7-2 医事課からみた治験と診療報酬について 岡﨑 純子(熊本大学病院 医事課)
- SY7-3 臨床看護師が治験に参加する患者のケアにかかわること 中濱 洋子(国立がん研究センター中央病院 臨床研究支援部門/看護部)
- SY7-4 臨床検査技師からみたCRCさん --こんなイメージを持ってます-- 田中 秀磨 (大阪はびきの医療センター 臨床検査科)
あなたは「CRCって何?」と聞かれたときに何と答えますか?
治験、臨床試験を円滑に進めるためには、各部門との調整は必要不可欠です。なのに、院内スタッフとのコミュニケーションが上手くとれずに苦労したことはありませんか?
本会議も今年で20回を迎えますが、20年前からCRCが悩んできた「他部門との調整」について考えます。人との関わり、他部門との関わりはCRCの原点です。CRCには「治験の知識」だけではなく「各部門の業務の現状や環境を理解する力」が必要です。本セッションは、どうやったら治験に協力してもらえるのかを考えるために、各部門から「治験に対して、負担に思っていることや困っていること」を発表してもらい、そこから調整にはなにが大事かを探っていきます。「出来てますよ」ではなく「困ってます」という事象に目を向けることで、お互いを理解し信頼へとつながっていくと考えます。「困っていた」から「こんな風に工夫している」という意見も聞きながら、これからの方向性を一緒に考えて行きましょう。
治験・臨床試験は病院全体で行うもの、患者様には病院として医療を提供すること、治験・臨床試験の質を上げるのも病院全体で行うべきことという観点から、体制についても考えていきたいと思います。体制を整え、各部門が治験に積極的に参加してもらうことがQMSの観点からも重要となります。
また、「困っていること」を聞き、着地点を見つけることが、それぞれの業種の中で「治験」に対してのムーブメントを起こすきっかけになるかもと思ったりしますが、いかがでしょうか。
シンポジウム8初・中・上
CRC・事務局スタッフ教育の現状とこれから(本質の理解に繋がる関わりとは?)
- 座長
- 木俣 美津夫(聖隷浜松病院 臨床研究管理センター)
- 佐々木 由紀(北海道大学病院 臨床研究開発センター)
- 演者
- SY8-1 CRCの育成に関する現状と課題 小原 泉(自治医科大学 看護学部/附属病院臨床研究センター)
- SY8-2 がん専門病院におけるCRC教育の在り方 宋 菜緒子(がん研究会有明病院 臨床研究・開発センター 企画・品質管理部 臨床研究推進室)
- SY8-3 日本病院薬剤師会によるCRC・事務局スタッフ教育研修について 酒井 隆浩(日本病院薬剤師会 臨床研究推進委員会)
- SY8-4 治験・臨床研究事務局スタッフが望む教育について考える 雪吉 歌小里(岡山大学病院 新医療研究開発センター 治験推進部)
本邦においてCRCの育成が開始されてから早20年が経過した。CRCの育成に関しては、平成27年に「臨床研究コーディネーター養成カリキュラムの標準化に関する研究」班より提示されたシラバスが基本骨格とはなっているものの、その教育体系は未だ確立されたものはなく、各医療機関でのOJTを中心とした育成が主になっている現状がある。また、臨床研究・治験事務局スタッフにおいては、その役割の重要性が認識されている一方で、その教育・育成についてほとんど議論されてくることはなかった。そこで今回、CRC教育のこれから、そして臨床研究・治験事務局スタッフの教育のこれからについて議論する機会を設ける必要があると考え、本シンポジウムを企画した。CRCの教育・育成に関する最新の調査研究成果の共有、医療機関における実際の取り組み事例、及びCRCや事務局スタッフの育成において標準的な視点を学ぶ上での重要な役割を担ってきた各種職能団体による外部教育研修への取り組み事例の紹介を通じて、複雑化するプロトコルや規制に柔軟に対応するために必要な「本質の理解」に向けて、今後必要とされる教育の形や内容、継続性や連動性などについてディスカッションを行い、真に求められている育成への取り組みを見出したい。
シンポジウム9中
「自発的な」同意の意思って?
- 座長
- 田代 志門(東北大学大学院 文学研究科)
- 都祭 紗和子(国立がん研究センター中央病院 臨床研究支援部門 研究企画推進部 企画管理室)
- 演者
- SY9-1 インフォームド・コンセントはどう変わるか 田代 志門(東北大学大学院 文学研究科)
- SY9-2 Common rule改定を受けた、同意説明文書会社テンプレートの変化および企業内の取り組み 江坂 悦子(ファイザーR&D合同会社 クリニカル・リサーチ統括部 クリニカル・サイエンス部)
- SY9-3 簡潔でまとまった鍵となる情報の提示のためのICF作成のチャレンジ 西田 朋子(九州大学病院 ARO次世代医療センター/薬剤部)
- SY9-4 electric Informed Consent を経験して、改めて考えるCRCの役割 工藤 夏美(北海道大学病院 臨床研究開発センター)
臨床試験に参加する患者の自発的な同意の意思表明は、基本中の基本としてニュルンベルグ綱領、ヘルシンキ宣言でも求められているところである。その意思決定のために必要な情報を提供するため、文書が作成されるわけであるが、GCP省令第51条に定められた15(18)項目を説明するために、その文書のボリュームが年々膨大化している現状がある。
米国でも同じような課題に対して、数年にわたり議論が重ねられ、長さ(ボリューム)制限の導入は見送られたものの、臨床試験への参加の判断の助けになる、簡潔でまとまった鍵となる情報の提示をまずは行うようcommon ruleが改訂されたことは、第17回のCRCと臨床試験のあり方を考える会議2017in名古屋でも取り上げられた。名古屋のシンポジウムでは、「簡潔でまとまった鍵となる情報の提示」の方法について、CRCの立場でも考えていこうということが、宿題として共有された。その後、3年の間に、自発的同意の意思表明にむけた説明の手法は変化を遂げ、電子版同意説明文書(electric Informed Consent)も導入されてきている。
このような変化を踏まえ、これまで「より被験者/候補者にわかりやすい説明同意文書の作成」「自発的同意の意思表明のための支援」を担ってきたCRCの役割にも変化が必要なのか、どのような役割が期待されるのかを考える機会としたい。
シンポジウム10中
患者・一般市民が治験・臨床試験に参画するためにCRCにできることを考えよう
- 座長
- 高村 美喜子(熊本大学病院 臨床試験支援センター)
- 中村 健一(国立がん研究センター中央病院 臨床研究支援部門 研究企画推進部)
- 演者
- SY10-1 日本の研究開発における患者・市民参画(PPI)について:
次の一歩を考える 東島 仁(千葉大学大学院 国際学術研究院) - SY10-2 研究者サイドからみた患者・市民参画のWHYとHOW 中村 健一(国立がん研究センター中央病院 臨床研究支援部門 研究企画推進部)
- SY10-3 「患者中心」を考えた、治験・臨床試験の情報公開、実施計画書立案やICF作成の取り組み 明石 晃代(徳島大学病院 総合臨床研究センター)
- SY10-4 患者側からみた臨床試験 中村 尚司(一般市民・学生)
医学研究・臨床試験における患者・市民参画(PPI:Patientand Public Involvement)では、「患者・市民が研究者とパートナーシップを結びながら、研究の計画、デザイン、管理、評価、結果の普及に関わること」、「研究のあらゆる段階において患者・市民から意見を聴取する機会を確保すること」などが求められています。欧米を中心にこの取り組みは進んでおり、研究者と患者をつなぐコーディネーターが患者・市民参画の調整をしているケースもあります。日本でも、2019年1月の厚生労働省臨床研究部会でPPIの取り組みが記載され、また、がん対策推進基本計画、医療分野研究開発推進計画、厚生労働省・免疫アレルギー疾患研究戦略検討会等でも、PPIについて言及しています。本会においても、最新の国内外の現状と産官学・患者支援団体における取り組みの紹介等を通した議論が始まっております。
本シンポジウムは、より身近な現場の中で、すでにPPIにご尽力されている方々の経験やノウハウ、一般市民の生の声を知り、課題や展望を皆で共有することを目的としています。PPIの理念・意義を学び、「PPIとは、何なのか?」「何をすればよいのか?」「誰にどんなメリットがあるのか?」「注意すべきことは何なのか?」を考え、PPIの本質である「患者が必要とする医療を患者に届けること」のために研究者と患者の協働に繋げるヒントを探ります。
シンポジウム11初・中
臨床試験・研究でIoTツールの利用は本当に必要か? 〜IoTツールの原点を探る〜
- 座長
- 森本 陽子(メディデータ・ソリューションズ株式会社、日本QA研究会 GCP部会特別プロジェクト4グループ幹事)
- 演者
- SY11 臨床試験・研究でIoTツールの利用は本当に必要か?
〜IoTツールの原点を探る〜 森本 陽子(メディデータ・ソリューションズ株式会社、日本QA研究会 GCP部会特別プロジェクト4グループ幹事) - 若井 修治(日本医師会治験促進センター)
- 氏原 真美(IQVIAサービシーズ ジャパン株式会社/日本QA研究会 GCP部会)
近年、臨床試験・研究はますます長期化・複雑化する傾向にあり、また同時に、グローバル化も広がりを見せている。そんな中、IT技術の発達を伴って新たなIoTツールが続々と登場し、臨床試験・研究の中でもIoTの活用が増加している。これらIoTツールを利用する目的は主に作業の効率化であるが、使用する医療機関においては、使用方法を習得することに時間がかかったり、業務プロセスや手順書等の見直しや変更を伴うことが多く、効率化するために時間を要するという状況に陥り、なぜIoTを導入しなければいけないのかという疑問に至ることが少なくないように見受けられる。
そこで、本セッションでは、依頼者側と実施医療機関の両方の立場から見た、活用状況、利点・課題や留意点、記録の電磁化との繋がり等について明らかにし、依頼者側と実施医療機関の双方が正しくIoTツールを理解し、データ品質の向上と効率化という目的を一緒に目指していけるよう理解を深めていただく足がかりとしたい。本セミナー後に、IoTツールを知ることで、とりあえず使う、とりあえず使わないではなく、施設ユーザ側から使用の可否を提案されるようになることが望まれる。
講演後討論内容(例)
・医療機関が使っているIoT ツールを利活用するために必要なもの
・臨床試験に関わる記録の管理は、紙がいいか電子データがいいか
・CRC の人のIT に対する知識向上、共通教育とは
教育セッション1初・中
なぜ?どうして?実施プロセスや手順の本質を洞察できるようになろう!
- 座長
- 山崎 真澄(がん研究会有明病院 先端医療開発センター ゲノム診療部)
- 布村 正樹(株式会社新日本科学PPD グローバル臨床開発)
- 演者
- ES1-1 臨床試験に関する倫理的原則やルールを基礎から理解しよう 成川 衛(北里大学大学院薬学研究科 医薬開発学)
- ES1-2 医療機関選定や実施可能症例数調査の流れを理解しよう 田之頭 淳一(日本製薬工業協会 医薬品評価委員会 臨床評価部会/武田薬品工業株式会社)
- ES1-3 治験実施計画書上の手順の意味を深く理解しよう 山崎 真澄(がん研究会有明病院 先端医療開発センター ゲノム診療部)
- ES1-4 Patient Reported Outcome(PRO)評価の背景と目的・本質を理解しよう 下妻 晃二郎(立命館大学 生命科学部 生命医科学科 (医療政策・管理学))
皆さんは、CRC業務において、「どうしてこんな手順になっているのか?」「なぜこの書類を作成しているのか?」「被験者リクルートって言われてもそんなに症例いないし…」など様々な疑問を感じていませんか。そして疑問に思っても日常業務の忙しさもあり、「先輩からこの手順で実施すればいいって習ったから」「モニターさんにこの書類を用意するように指示されたから」等、その本質を深く洞察する間もなく、「言われた通りにしないと」とプロトコルの記載に振り回されながら必死で頑張っているCRCもいるのではないでしょうか。
本セッションでは、CRCの皆さんの日頃の悩みを少しでも解消できるように次のようなプログラムを企画しました。①臨床試験を実施するときの倫理的原則やGCPなどのルールをあらためて本質から理解する、その上で、②医薬品の早期承認及び患者さんへの早期提供を目指し合意症例数を予定通りにエントリーするために、医療機関の選定や実施可能症例数の調査がどのように行われるのかといった手順、③プロトコルのスケジュール表に規定されている「実施項目」の意味や本質、④治験特有の評価であるPatient Reported Outcome(PRO)の目的や本質について取り上げました。各演者より、責任医師等と協力して専門的な立場でサポートを行うとともに、患者さんと直に接して説明やサポートを行うCRCの皆さんが、治験実施計画書に則ったうえで円滑に治験を実施できるよう、必要な知識や心構え等を共有いただきます。
治験プロセスやその手順の根拠や本質を十分に理解することで、プロトコルの表面上の記載に振り回されることなく、自信を持ってCRC業務ができると考えます。被験者の安全を守り、科学的な治験を実施するために、本セッションでプロセスや手順の本質を理解しましょう。
教育セッション2中
がんゲノム医療から研究へ ~CRCのかかわりを考える~
- 座長
- 稲田 実枝子(北九州市立病院機構 北九州市立医療センター 臨床研究推進室)
- 小橋川 智美(長崎大学病院 臨床研究センター)
- 演者
- ES2-1 がんゲノム医療の現状と臨床研究の実際 下井 辰徳(国立がん研究センター中央病院 乳腺・腫瘍内科)
- ES2-2 がん遺伝子パネル検査の実装
~がんゲノム医療拠点病院の立場より~ 芦澤 和人(長崎大学大学院 医歯薬学総合研究科 臨床腫瘍学) - ES2-3 がんゲノム医療における遺伝カウンセラーの役割 鹿田 佐和子(九州大学病院 臨床遺伝医療部)
- ES2-4 がんゲノム医療において期待されるCRCの新しい役割 村崎 由佳(名古屋大学医学部附属病院 先端医療開発部 先端医療・臨床研究支援センター)
近年、ゲノム医療、遺伝子関連検査の発展に伴い、CRCは治験・臨床試験で被験者へ遺伝子関連検査について説明を行う機会が増えている。患者や家族は、治験の説明を受けて初めて遺伝子検査とその結果の意味を知る場合もある。そのためCRCは、患者や家族への意思決定支援を行ううえでも遺伝子検査の内容や結果の考え方などを最低限、正しく理解し、どういう対応が必要かなど考慮しておくことが必要である。一方で、国策としてがんゲノム医療が推し進められ、医療としてゲノム解析が実施されるようになってきた。2018年度以降、がんゲノム医療中核拠点病院・がんゲノム医療連携病院等の医療機関も増え、院内体制も全国的な整備が整えられるなか、がんゲノム医療コーディネーターなどの人材育成も急速に行われている。患者への間口は広がり、治療法を見つけるためにがん遺伝子検査パネルでの検査を受ける機会があり、遺伝子変異に対して効果が期待できる薬であればその患者さんにとっては、方針決定を行う際、治験や臨床研究も選択肢の一つになる。今後、がんゲノム医療(ゲノムシークエンス)の結果、臨床研究が実施されることになった時に、CRCは何ができるのか、何をしないといけないのか、具体的なかかわりや今後の課題など情報共有できる機会としたい。
教育セッション3初・中
再生医療の基本を知ろう ~iPS細胞治験ってなに?遺伝子治療ってなに?
ウイルスベクターってなに?カルタヘナ法ってなに?~
- 座長
- 内山 徹(国立成育医療研究センター 成育遺伝研究部)
- 宮前 由里恵(国立成育医療研究センター 臨床研究コーディネートユニット)
- 演者
- ES3-1 日本と海外規制の違い、カルタヘナ法について 内田 恵理子(国立医薬品食品衛生研究所 遺伝子医薬部)
- ES3-2 再生医療~遺伝子治療と細胞治療~ 内山 徹(国立成育医療研究センター 成育遺伝研究部)
- ES3-3 遺伝子治療治験における調整について 門崎 すなほ(熊本大学病院 臨床試験支援センター)
- ES3-4 遺伝子治療・再生医療臨床研究における倫理的配慮 高嶋 佳代(京都大学iPS細胞研究所 上廣倫理研究部門)
- ES3-5 iPS細胞の治験・臨床研究におけるCRCの役割とは
松山 倫子(京都大学医学部附属病院 薬剤部/先端医療研究開発機構 臨床研究支援部/
次世代医療・iPS細胞治療研究センター(Ki-CONNECT))
遺伝子治療とは、疾患の治療を目的として、遺伝子または遺伝子を導入した細胞をからだの中に入れる治療法です。海外では遺伝子治療の臨床試験が2000件以上実施されており、日本でも治験や臨床研究の実施件数が増加しています。遺伝子治療の中には、法規制が厳しく、実施施設では「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)」第一種使用規程への対応方法(例えば、採血後の採血管はどこで処理するか?リネン類はどうするか?排泄物の処理方法など)について、関連部署との調整・協力が必要になる場合があります。しかし、カルタヘナ法第一種使用規程の適応であっても、ベクターの種類によっては、患者さんからのウイルスベクター排出について、細かい注意をすることなく自宅で日常生活を送れる場合もあります。その違いの理由は、遺伝子治療の臨床研究や治験を実施するうえで必要な知識になります。使用する製品の特性によって、安全性の注意点なども異なります。また、再生医療ではiPS細胞治験が開始されていて、新しい治療法の開発が進んでいます。しかし、遺伝子治療やiPS細胞治験についてCRCが勉強したくても、医療者向けの書籍などが少なく、困ることが多いと思います。
このシンポジウムでは、CRCとして知っておきたいiPS細胞治験や遺伝子治療とカルタヘナ法の基本、実施施設で注意すべきことなど、遺伝子治療治験、iPS細胞治験の本質について知る機会にしたいと思います。
教育セッション4中
臨床試験の国際化の流れの中で、ICHガイドラインやGCP Renovationの本質への理解を深め、臨床試験の実施に与える影響を考えよう!
- 座長
- 大澤 智子(医薬品医療機器総合機構 信頼性保証部)
- 松澤 寛(日本製薬工業協会 医薬品評価委員会 臨床評価部会/アステラス製薬株式会社)
- 演者
- ES4-1 ICHオーバービューとICH E8(R1)の最新動向 坂口 宏志 (医薬品医療機器総合機構 新薬審査第一部)
- ES4-2 ICH E6(R3)の最新動向 北林 アキ (医薬品医療機器総合機構 信頼性保証部)
- ES4-3 アカデミアの立場から見たGCP Renovationによる変化と期待 渡邉 裕司 (浜松医科大学)
- ES4-4 GCPリノベーション:準備を始めないと間に合いませんよ 小宮山 靖(日本製薬工業協会 医薬品評価委員会データサイエンス部会/ファイザーR&D合同会社)
- ES4-5 医薬品医療機器等法及びGCP省令改正を併う治験関連制度の
見直し 武内 聡(厚生労働省医薬・生活衛生局 医薬品審査管理課)
医薬品の世界同時開発及び国際的な医薬品の安全性確保等を目指してグローバルな医薬品規制の調和を図るため、ICH(International Council for Harmonization of Technical Requirements for Pharmaceuticalsfor human use:医薬品規制調和国際会議)の場において活発な議論が行われ、種々のICHガイドラインの作成が行われている。
種々のICHガイドラインの中で、臨床試験の倫理性、科学性の確保に大きな役割を果たしてきたGCPは、大きな転換期を迎えている。“GCP Renovation”では、「多様化が進む臨床試験の目的や状況に応じて満たすべき基準は変わるため、その目的や状況に合わせて被験者保護とデータの信頼性を確保しながら適切で柔軟に対応できる指針を提供する」こととされ、まずICHE8(R1)(臨床試験の一般指針)で大きな考え方が示された。本邦でも2019年5月~9月にガイダンス案への意見募集が行われたところである。これに続くICHE6(R3)(医薬品の臨床試験の実施基準)の議論も開始され、GCP以外にもICHの場では、臨床試験の実施に密接に関係する種々のガイドラインの新規作成や改訂・補遺の議論が進んでいる。
臨床試験に関わる関係者がそれぞれのガイドラインの背景や内容の本質への理解を深め、日本で実施する臨床試験への影響や医療機関側で必要となる対応等について、考え行動することは重要である。今回、急遽、GCP省令等の改正を伴う治験関連制度の整備についても厚生労働省より解説いただけることとなった。本教育セッションを、臨床試験の国際化の流れの中で臨床試験を実施する現場に有用となる学びの場としたい。
教育セッション5中
リアルワールドデータ(RWD)の利活用に向けて
- 座長
- 中村 治雅(国立精神・神経医療研究センター トランスレーショナルメディカルセンター
臨床研究支援部) - 大澤 智子(医薬品医療機器総合機構 信頼性保証部)
- 演者
- ES5-1 造血細胞移植と細胞治療レジストリ
-CAR-T治療アウトカム情報の産官学による利活用に向けて- 熱田 由子(一般社団法人 日本造血細胞移植データセンター) - ES5-2 レジストリ構築と薬事目的の利活用:現状と課題 柴田 大朗(国立がん研究センター 研究支援センター 生物統計部)
- ES5-3 データ駆動型臨床研究の期待と課題 中島 直樹(九州大学病院 メディカル・インフォメーションセンター)
- ES5-4 リアルワールドデータが担う未来
~医療における RE-Engineering ~ 徳増 裕宣(大原記念倉敷中央医療機構 臨床医学研究所 臨床研究支援センター/
リアルワールドデータ株式会社) - ES5-5 Real World Dataへの期待 ―製薬企業の立場から― 東郷 香苗(日本製薬工業協会 医薬品評価委員会 臨床評価部会/ファイザー株式会社)
近年、医療分野におけるリアルワールドデータ(RWD)の利活用への期待は高まっており、海外では規制判断での利活用に向けた文書が発出されるなど、RWDを利用した医薬品開発の促進が図られている。本邦においても、閣議決定に基づきクリニカル・イノベーション・ネットワーク(CIN)が構築され、その基本方針に掲げられた“RWDの創薬や医療の場での有効活用”に向けた取り組みが進められている。
RWDの今後期待される用途として、承認申請や再審査申請等への利活用が挙げられる。貴重な医療データのより有効な利活用は誰もが望むところである一方、今後の医療のあり方につながる規制判断の根拠となるデータの信頼性、質を蔑ろにすることはできない。
そもそも“RWD”とは何を指し、どのような特徴があるのか、どのようなデータをどのように使うことが目的にかなうのか等々、私たちが“RWD”という言葉について共有できていることは実は限られているように思う。また、関係者には、データを提供する立場、管理する立場、利用する立場、規制する立場等、様々な立場が考えられるが、今後協調していくためには、それぞれが自身と異なる立場を理解する必要があるだろう。相互理解のもと、データの信頼性確保の意義・本質を見失うことなく、今後のあるべき姿を共有し、その実現に向けた取り組みを進めていくことが大切なのではないだろうか。
本セッションでは種々の立場のRWD関係者から現状と課題をご紹介いただき、今後の方向性やそれに向けての包括的な課題、その解決策を考える機会としたい。
座談会中・上
これって、本当?海外規制 Q&A ~海外規制の本質を知ろう!~
- 座長
- 平山 清美(MSD株式会社 グローバル研究開発本部 クオリティマネジメントユニット)
- 土屋 友美(国立研究開発法人 国立がん研究センター中央病院 臨床研究コーディネーター室)
- コメンテーター
- 松下 敏(ヤンセンファーマ株式会社 クオリティアンドコンプライアンスマネジメント部
トレーニングコーディネーショングループ) - 村上 竜哉(ファイザーR&D合同会社 クリニカル・オペレーション統括部)
- 林 健(アストラゼネカ株式会社 Quality Assurance Asia Pac)
“海外規制と言われているけど、本当?”“これって海外規制というけど、何のために必要なの?”“本当にFDAやEMAはこんなことを求めているの?”という疑問を持ったこと、ありませんか?CRAに聞いたけど明確に理由を説明してもらえず、“海外からの指示です”とだけ言われ、悶々としている・・・ことって、ないですか?
本セッションでは、事前登録者より“海外規制のこれって本当?何のため??”に関する質問を収集し、その質問を基に外資製薬企業で規制に詳しい方がコメンテーターとなり、リモート座談会を行い、海外規制の本質にせまります!
“悶々”を吹き飛ばし、“本質”を知って、スッキリしましょう!
時間内にできるだけ多くの質問をしっかりと議論したいので、質問は事前収集させて頂く予定です。リモート座談会参加者は医療機関関係者(SMO含む)のみとなります。フリーディスカッションは予定しておりません。
例
・統一書式の分担リストはなぜDelegationlogとして認めてくれないの?何が違うの??
・採血やバイタル測定に関わる全てのスタッフをDelegationlogに載せる必要があるの?
・精度管理記録はどこまで記録を残しておく必要があるの?日常点検はどこまで必要?
・Financial Disclosureって、何のために集めているの?CRCも必要??
ワークショップ上
CRCマネジメント、どうやっていますか? マネジメントの原点を考える
- 座長
- 鈴木 由加利(新潟大学医歯学総合病院 臨床研究推進センター 臨床研究実施部門)
- 加藤 みどり(シミックヘルスケア・インスティテュート株式会社)
- ファシリテータ
- 今野 浩一(PMコンサルティング ポジティブ・インテンション)
CRCは被験者となる一人ひとりを尊重し、権利の擁護者として自由な意思決定支援を行うとともに、実施計画に従い健全なチームビルディングのもと安全な実施を目指す活動を行っています。個々のCRCが属するチームには、プロジェクトや組織をマネジメントする指導者がいます。
指導者は自らの信念を持ちチームメンバーへの助言の他に、情勢を受け入れ変革していく力や、人材育成など様々な役割を期待され、日々前向きにチームメンバーのパフォーマンスを最大限に発揮できるようリーダーシップのもと活動していると思われます。
このワークショップでは、喫緊のイノベーションへの取り組みや実行に向けた他部署間との交渉や提案そして決断を行うなど、CRCという組織をマネジメントしている指導者たちの「ありたいと考え実行する姿」や「これでよかったのだろうか?」という思いを、ワールドカフェスタイルで語り合います。
参加者のそれぞれの語りを聴き、自らにはない新たな気づきの発見や、自らの気持ちを語ることによる気づきを、“対話”を通し体感します。参加者それぞれが、自らが大切とする原点を再認識し、施設を超えて繋がる心強さや手ごたえが原動力となるようなワークショップにしたいと思います。
申し込み対象者の条件
1.CRCの指導者としてプロジェクトや組織をマネジメントする役割を担っている人
(所属は施設、SMO問いません)
2.マネジメントに関する成功体験や苦労体験がある人
3.ご自身のパソコンからWeb会議への参加(カメラ、マイク)が可能な人
共催セミナー1
グローバル試験から排除されないために
~コスト意識が日本の治験を活性化する~
- 座長
- 渡邉 祐介(米国研究製薬工業協会 臨床部会/ヤンセンファーマ株式会社)
- 吉野 友明(欧州製薬団体連合会 臨床部会/サノフィ株式会社)
- 演者
- PhRMA/EFPIA Japan CRC と臨床試験のあり方を考える会議 2020 実行委員
- 共催
- PhRMA/EFPIA Japan
本セッションへの皆さまのご参加がより有意義になりますように、セッションテーマに関する皆さまの声をお聞かせいただきたいと思いますので、アンケートにご協力くださいますようよろしくお願いいたします。
共催セミナー2
おさえておきたい治験英語
- 座長
- 植松 尚(一般社団法人 日本CRO 協会)
- 演者
- 木次 佳太(サン・フレア アカデミー)
- 共催
- 一般社団法人 日本CRO 協会/サン・フレア アカデミー
共催セミナー3
今こそ高まる共通化と効率化の必要性:
RBM、Common SAE field 報告及びProtocol Deviation
- 座長
- 大司 照彦(塩野義製薬株式会社 医薬開発本部)
- 演者
- 半田 智和(ヤンセンファーマ株式会社 研究開発本部 トライアルリード部)
- 小倉 江里子(塩野義製薬株式会社 医薬開発本部)
- 西田 千聡(MSD 株式会社 グローバル研究開発本部)
- 共催
- TransCelerate
共催セミナー4
臨床開発を再起動させるために ~コロナ禍での臨床開発の未来像を考える~
- 座長・演者
- 柳生 直紀(メディデータ・ソリューションズ株式会社 ソリューション コンサルタント)
- 共催
- メディデータ・ソリューションズ株式会社
共催セミナー5
クラウド型文書管理システム活用における治験・臨床研究の品質管理向上と効率化
- 座長
- 小居 秀紀(国立研究開発法人 国立精神・神経医療研究センター(NCNP))
- 渡部 歌織(東京大学医学部附属病院 臨床研究推進センター)
- 共催
- アガサ株式会社
- 演者
- 鹿児島大学病院治験管理部門におけるAgatha クラウドシステムを用いた
電磁化対応 益田 将吾(鹿児島大学病院 臨床研究管理センター 治験管理部門/鹿児島大学病院 薬剤部) - 福岡市立こども病院におけるクラウドシステム導入事例
~ペーパーレス化から新型コロナウイルス感染症への対応まで~ 仲島 しのぶ(福岡市立こども病院)
下記の資料をダウンロード頂けます。
①鹿児島大学様によるAgatha導入事例
②福岡こども病院様によるAgatha導入事例
資料ダウンロードはこちらから
https://www.agathalife.com/event-form/arikata2020-webseminar/
共催セミナー6
臨床研究情報ポータルサイトの利用価値と医療のリアルワールドデータの今後の
活用の方向性
- 演者
- 湯川 慶子(国立保健医療科学院 政策技術評価研究部)
- 水島 洋(国立保健医療科学院 研究情報支援研究センター)
- 共催
- 公益社団法人 日本医師会治験促進センター
共催セミナー7
信頼性は監査が保証するものじゃない、現場が保証するものだ!
- 座長
- 小澤 正明(シミックヘルスケア・インスティテュート株式会社/一般社団法人 日本QA 研究会
GCP 部会) - 演者
- 中村 宏治(北海道大学病院 臨床研究開発センター/一般社団法人 日本QA 研究会 GCP 部会)
- 共催
- 一般社団法人 日本QA 研究会
![第20回 CRCと臨床試験のあり方を考える会議 2020 in 長崎 [The 20th Conference on CRC and Clinical Trials 2020 in Nagasaki]](img/pc_header_title.png)
![第20回 CRCと臨床試験のあり方を考える会議 2020 in 長崎 [The 20th Conference on CRC and Clinical Trials 2020 in Nagasaki]](img/sp_header_title.png)