
プログラム・日程
主要プログラム



プログラム一覧
基調講演
9月17日(土) 10:00~11:00
第2会場 朱鷺メッセ 新潟コンベンションセンター2F(メインホールA)
座長:鈴木 由加利(新潟大学医歯学総合病院 臨床研究推進センター)
演者:中野 重行(大分大学 名誉教授)
特別講演
9月18日(日) 10:00~11:00
第2会場 朱鷺メッセ 新潟コンベンションセンター2F(メインホールA)
座長:田中 基嗣(新潟大学医歯学総合病院 臨床研究推進センター)
演者:藤原 康弘(独立行政法人 医薬品医療機器総合機構)
教育講演
9月17日(土) 11:10~11:40
第2会場 朱鷺メッセ 新潟コンベンションセンター2F(メインホールA)
座長:矢野 宜昭(一般社団法人 日本QA研究会 GCP部会)
演者:岩崎 優(厚生労働省 医薬・生活衛生局 医薬品審査管理課)
シンポジウム
「訪問看護を活用したDCT(医療機関への来院に依存しない臨床試験)について考えよう
~Patient Centricityのためにできること~」
9月17日(土) 10:00~12:00
第3会場 朱鷺メッセ 新潟コンベンションセンター2F(メインホールB)
座長:山﨑 純子(神戸大学医学部附属病院 臨床研究推進センター)
座長:矢田 巳貴(株式会社 EP綜合 品質管理部)
Patient Centricity の概念に 基づく取り組みは臨床試験への患者参画を促し、「医療機関への来院に依存しない臨床試験(DCT)」として治験においても導入され始めている。しかし、プロトコルのスケジュール表に、『Home Visit やHome Nursing:家で治験薬の投与や検査等の評価ができる』と記載されていても「日本では体制が整っていないので実施しません。通常通り来院Visit で実施してください」と回答されることも多く、訪問看護を組み合わせた治験はほとんど実施されていないのが現状ではないだろうか。治験へ参加するハードルの一つに『定期的に病院へ通院すること』があり、特に自身で通院できない患者(例えば、アルツハイマー型認知症や脳神経疾患、小児など)の場合には、ご家族など周囲の協力によって、治験参加が叶っているといえる。治験の同意説明では「家族が仕事をしているから、兄弟がいて通院に付き添えないから、等の理由により参加したくてもできない」という声を聴くことがある。
また、患者は「一人では通院ができないから周りに迷惑をかけている。なるべく学校を休まなくてもよいスケジュールにしてほしい」など多くの負担を感じながら医療機関へ通院し、治験を継続している。そこで、医療機関への通院や滞在時間等の負担を低減する方策の一つとして本シンポジウムでは『訪問看護を活用したDCT』に焦点を絞り、日本における現状や関連法規、実際の事例を紹介する。
関係者で知識や経験を共有し、訪問看護を活用するなど様々な形のDCTが普及し、より良い治験の実施体制が構築されることを願っている。
演者:浜田 隼輔(日本製薬工業協会 医薬品評価委員会 臨床評価部会)
演者:丸山 薫(3Hメディソリューション株式会社)
演者:佐藤 康敬(徳島大学病院 総合臨床研究センター)
演者:久保田 有香(群馬大学医学部附属病院 臨床試験部)
演者:松村 貴子(埼玉医科大学病院 治験事務室)
CRCがサステナブルな職業であり続けるために必要なこと~環境・教育編~
[連携企画
●シンポジウム8:サステナブルな職業であり続けるために大切なこと~マジメント編~
●事前教育オンデマンド配信:E-2 職場におけるメンタルヘルスの取り組み~自分も周りも大切にするコミュニケーションを目指して~]
9月17日(土) 14:00~16:00
第3会場 朱鷺メッセ 新潟コンベンションセンター2F(メインホールB)
座長:鶴丸 雅子(長崎大学病院 臨床研究センター)
座長:稲田 実枝子(北九州市立病院機構 臨床研究推進センター)
日本でCRCが誕生して20年以上が過ぎ、臨床研究・治験の支援者として必要不可欠な役割を担っていることは周知の事実である。CRC 業務は専門性が高く、一人前になるには少なくとも3 年はかかる。学ぶべきことが多く医療従事者の免許取得者でさえ、誰もがすぐにできる業務ではない。にもかかわらず医療機関では有期雇用を強いられ、雇用条件が良いとはいえない環境下にあるCRC も多い。また、リソース不足のため個人の努力で成り立っている環境や、医療機関の支援体制が不十分な中で責任ある業務を担わざるを得ない環境にあるCRCも少なくない。「CRCになりたい」、「CRCを長く続けていきたい」と思える環境はどうあるべきだろうか。
本シンポジウムでは、臨床研究中核病院などの環境が整っている医療機関だけでなく、その他の多くの医療機関、SMO の支援のみで実施している医療機関など、様々な環境の課題を丁寧に共有するために、事前に意見を集めることとした。そして、当日は、環境改善、OJTを含む教育の充実への糸口、みなさんの目指すCRCについてディスカッションを予定している。
CRC に魅力を感じて、新たな職業として選択し、サステナブルな職業であり続けるために、私達が今できることは何か、CRCの「あるべき姿」について議論したい。
演者:鶴丸 雅子(長崎大学病院 臨床研究センター)
演者:鳥口 尚子(日本イーライリリー株式会社)
演者:久木田 和泉(株式会社 EP綜合)
演者:稲田 実枝子(北九州市立病院機構 臨床研究推進センター)
臨床研究支援のこれからのあるべき姿を見据えて
– 時は今、CRCの経験・視点を研究計画立案へ –
[連携企画
●ワークショップ2:ワークショップで体験しよう!-「シンポジウム:臨床研究支援のこれからのあるべき姿を見据えて」実体験版 ―]
9月17日(土) 10:00~12:00
第5会場 朱鷺メッセ 新潟コンベンションセンター3F(中会議室301)
座長:桃井 章裕(慶應義塾大学病院 臨床研究推進センター)
座長:成田 さわな(熊本大学病院 臨床試験支援センター)
今の時代ほど“ 多様性“ という言葉の重要性が声高に叫ばれる時代はないと言っても過言ではないであろう。それは我々の社会が抱える問題( 気候変動や世界的パンデミックなど) が凄まじい勢いで変化、つまりVUCA(Volatility(変動性)、Uncertainty(不確実性)、Complexity(複雑性)、Ambiguity(曖昧性))化しているからに他ならない。さらには各個人の専門領域が細分化されるに伴い、複雑化した問題は個人で対応できる能力を遥かに凌駕している。そのため、個人や同質的( ホモ) な集団では対応できない問題に対して、異なる立場に身を置く個人や異質(ヘテロ)な集団の多様な視点・経験を積極的に導入することが社会的にも求められている。臨床研究支援に身を置く我々の業であっても例外ではない。医療技術の進歩の影で研究計画・研究支援が直面している問題は益々複雑化しており、効果的な多様性の導入が喫緊の課題と考えられる。このような研究環境の変化の中、AMED の研究事業において、研究者と研究支援者(PM/統計家/DM/CRC/CRA/倫理担当者)が研究計画の早期段階から協働することで、各支援者の持つコンピテンシーの相乗作用を通して、効果的に研究計画骨子の作成・ブラッシュアップができるプログラムが開発された。
この度、その概略と研究立案段階における多職種協働の有用性をシンポジウムにて紹介する(1 日目)。更に、シンポジウムでの内容を踏まえ、研究概要(シノプシス)のブラッシュアップを経験いただくワークショップを企画した(2日目、別企画案参照)。
各々が培ってきた経験とコンピテンシーをどのように研究計画支援に活用できるかを理解いただき、今後の臨床研究支援のあるべき姿を見定め 、各研究支援の現場に沿ったしなやかさを加えられる一助となれば幸いである。
演者:成田 さわな(熊本大学病院 臨床試験支援センター)
演者:真田 昌爾(神戸大学医学部附属病院 臨床研究推進センター)
演者:西﨑 祐史(順天堂大学医学部 医学教育研究室/順天堂大学医学部附属順天堂医院 臨床研究・治験センター)
演者:山口 拓洋(東北大学大学院 医学系研究科)
演者:髙田 宗典(東北大学病院 臨床試験データセンター)
演者:松嶋 由紀子(慶應義塾大学病院 臨床研究推進センター)
演者:岩崎 幸司(大阪大学医学部附属病院 臨床研究センター)
「デジタル時代の意思決定支援 ~変わっていくものと変わらずにあるべきもの~」
[連携企画
●事前教育オンデマンド配信:E4 臨床試験の参加を依頼する際に、CRCは何をどう支援するのか
●事前教育オンデマンド配信:E5 インフォームド・コンセントに際しての社会的意義の説明等について]
9月17日(土) 14:20~15:50
第5会場 朱鷺メッセ 新潟コンベンションセンター3F(中会議室301)
座長:松下 敏(ヤンセンファーマ株式会社 Bioresearch Q&C, Training Coordination G)
座長:池田 律子(滋賀医科大学医学部附属病院 臨床研究開発センター)
新型コロナ感染症を契機に、デジタルテクノロジーの活用が一層加速している。臨床試験においても、被験者の安全性やデータの信頼性を確保しつつ、被験者や関係者の負担を軽減しうるDCT等の来院に依存しない手法が検討され、同意取得の場にもe-consent が導入され始めている。e-consent とは、マルチメディアを用いた研究概要の説明、電子署名技術を用いた研究参加への同意取得など、電子的な説明から同意取得までの手法や電子ツールを指す用語で、特徴として、対面ではない遠隔地から説明や同意取得に利用でき、同意書や説明文書の版数や同意の記録などを電子的に管理できる利便性がある。
このようにe-consentの利用は同意プロセスの効率化に寄与することが期待される一方で、試験参加を検討するための情報を患者に伝え、理解を促すためのツールであることに変わりない。これまで説明の場で、CRCは単に文書を読み上げるのではなく、患者やその家族と向き合い、対話し、患者ごとに必要なことを共に考え、意思決定支援を支えてきた。たとえツールが変わっても、この姿勢に違いはなく、臨床試験の参加において患者からの自発的な同意は最も重要なことである。
そこで臨床試験参加者の経験をうかがい、意思決定支援の「あるべき姿」を今一度振り返る機会を持つと共に、e-Consent の導入を意識して、我々が変えてはいけない原則や、新しいツールを使用した支援のあり方、導入時の留意点などについて、シンポジストを交えて議論していきたい。
*治験に参加した患者さんと ご家族からの経験談
演者:藤田 美保(昭和大学横浜市北部病院 臨床研究支援室)
演者:田代 志門(東北大学 大学院文学研究科 社会学専攻分野)
「治験施設費用について考える ~現状の問題点の解決と今後向かっていく道~」
[事前学習リンク
●教育オンデマンド:「Fair Market Value」と「ベンチマーク型コスト」という用語解説など]
▶︎ 製薬協による解説
▶︎ R&D Head Club
*聴講いただく皆様には、議論を円滑に進めるため事前に動画を聴講、または資料に目を通していただき「Fair Market Value」と「ベンチマーク型コスト」という用語の意味等を確認しておいてください。
9月17日(土) 10:00~11:30
第7会場 朱鷺メッセ 新潟コンベンションセンター4F(国際会議室)
座長:後澤 乃扶子(国立研究開発法人 国立がん研究センター 中央病院)
座長:稲泉 恵一(ファイザーR&D合同会社)
パネリスト:安藤 菜甫子(国立研究開発法人 国立精神・神経医療研究センター病院 臨床研究・教育研修部門/臨床研究支援部 臨床研究・治験推進室)
日本における治験の施設費用に関しては、全額前払い制から出来高払いさらに実績時期に応じたマイルストーンペイメントが一般的となってきた。しかし、その算出方法についてはばらつきがあり、類似のいわゆる「ポイント表」を用いているのにも関わらず、算出金額は医療機関ごとに大きなばらつきがあると言われている。またポイント表以外の被験者に関わる治験費用に関しても医療機関ごと、依頼者ごとに解釈が異なあり契約交渉時に双方の窓口担当者(治験事務局やCRA等)の悩みの種になるケースも多い。 海外では、フェアマーケットバリュー(FMV)という考え方のもとプロトコルで規定された診察、検査、人件費などに基準値( ベンチマーク) を明らかにし、被験者のVisit 毎それを実績ベースで算出し支払いを行う形(ベンチマーク型コスト方式)が一般的であるため、日本のポイント表を用いた費用算出方法についてはグローバルの中で理解を得られにくいのが現状である。 このシンポジウムでは治験の施設費用に関して身近な問題点を明らかにし、解決の糸口を探るとともに、海外に一般に行われている算定方法の実際を知り、実際にポイント表から脱却して新たな費用算定にチャレンジしている施設の経験談を通して今後日本が向かっていく方向についてディスカッションを行う予定である。
現状の治験に関わる費用に関して大きく2パートに分けてディスカッションを行う。
- 「 他の施設はどうしてる?依頼者に請求している費用が妥当なのか?」身近な保険外併用療養費、負担軽減費関連に関して探る。 (2022/3/12 に東京都病院薬剤師会主催の研修会「改めて知りたい治験に関わる費用について」で参加者から出てきた問題点・ジレンマ等を取り上げそれをテーマにパネリスト及び座長間でディスカッションし解決の糸口をみつける。
- 「 他の国はどうしてる?」海外施設での治験費用のしくみやベンチマークコスト算定について概要をきき、さらに先行して取り組んでいる日本の医療機関の経験をもとにどのように課題を克服してきたかまた残されている課題そして日本はどこを目指していけばよいのか?をディスカッションしていきたい。
演者:若林 薫(東京都済生会中央病院 臨床研究センター)
演者:岡田 俊之(R&D Head Club/アステラス製薬株式会社)
「今だからわかる!遠隔地からの医療情報閲覧のあり方
~ 医療機関・治験依頼者双方から視る、リモートアクセスモニタリングへの取り組みと検討課題 ~」
9月17日(土) 14:20~15:50
第7会場 朱鷺メッセ 新潟コンベンションセンター4F(国際会議室)
座長:溝田 忍(徳洲会グループ 臨床試験部会)
座長:下河辺 純一(日本CRO協会)
治験活性化5か年計画2012の中でIT技術の更なる活性等の目指すことの一項目でリモートSDVが提唱され、その後様々な医療機関でリモートSDVの体制整備に向けた取り組みが開始された。しかし、物理的な問題や院内の承認等、様々な障壁もあり、その取り組みは限定的だった。
新型コロナウイルス蔓延によりSDV が実施できなくなり、安全性や品質を保ちながら治験を継続するために、遠隔からのモニタリング手法(リモートモニタリング(リモートアクセスモニタリング、リモートSDV 含む)) が必要となり、各医療機関においてリモートアクセスモニタリングやリモートSDV のための体制構築がなされた。
奇しくも新型コロナウイルス蔓延により遠隔地からの被験者の安全性やデータの品質の確保をどのように実施していくかについて、医療機関・治験依頼者双方で考える機会となり、多くの治験でリモートアクセスモニタリングやリモートSDVが実装され、多くの学会等で発表されており、2020年3月の緊急事態宣言から2年以上経過した現在において、そのノウハウはある程度蓄積・共有されつつある。
しかし、「どうやって安全性、人権の保護が守られていることを担保する?」、「SDV を成立させるためには、どういうことに注意して考えなければいけないのか」等、情報セキュリティやデータの品質の観点で「本当にこれでいいの?」という疑問はあり、まだまだ検討する必要があると考える。有事の際のみならず、新型コロナウイルス収束以降の治験環境の変化にも柔軟に対応できる体制を構築できるよう、リモートアクセスモニタリングやリモートSDV のあり方について、医療機関・治験依頼者それぞれの運営の視点から、改めて再検討する。
本シンポジウムでは、リモートモニタリングの中でも『リモートアクセスモニタリング』にフォーカスし、各医療機関で取り組まれているリモートアクセスモニタリングにおける情報セキュリティや閲覧データの信頼性の確保に対する運営方法(視点)について、医療機関・治験依頼者の双方からのベストプラクティスを共有し、これからの治験環境に向けたモニタリング体制構築の具体的な方策を検討する機会としたい。
演者:橋本 奈魅(熊本大学病院 臨床試験支援センター)
演者:奥田 浩人(岡山大学病院 新医療研究開発センター 治験推進部/薬剤部)
演者:本田 雄也(株式会社中外臨床研究センター スペシャリティ開発部)
演者:岩﨑 晋吾(エイツーヘルスケア株式会社 オンコロジー臨床開発第2部)
「中堅CRCの目指す道 ~自分の可能性を考えませんか。~」
9月18日(日) 9:00~11:00
第3会場 朱鷺メッセ 新潟コンベンションセンター2F(メインホールB)
座長:佐々木 由紀(北海道大学病院 臨床研究開発センター)
座長:白瀨 真由美(株式会社NTTデータ)
CRCという職種ができて20年以上が過ぎ、当初は手探りだったCRC業務も、業務が確立され、マニュアル化され、新人教育のカリキュラムはほぼ確立してきたと言える。しかしいわゆる中堅にあたるCRC(今回は3-5年目のCRCとした)の教育に関してはどうだろうか?中堅CRCへの教育は、育成の空白期間とも言え、日々の忙しい業務に追われ、目指す道を見つけられていないCRCもたくさんいるのではないだろうか? 新人教育とは異なり、中堅以降のCRCの目ざす道は1つではなく、1人1人違った、多くの目指す道(未来)があると考える。例えば
*CRCのスキルを売る(CRCとして活動)スペシャリスト
*CRCで培ったマネジメント力を売るジェネラリスト
*CRCで培った知識、経験を活かし路線変更のキャリアアップなど。今回このプログラムを行うに至った背景として、2021年1月に国立がん研究センター東病院で実施した、上級者臨床研究コーディネーター養成研修において実施したグループディスカッションの中の「教育」をテーマにしたグループディスカッションが発端となった。いろいろな施設の上級CRC同士が、中堅CRCを対象とした教育を考え時、「学会発表を目標にする」、「管理職を目標にする」などの意見がある中、「中堅CRCの目ざす道は1つではなく、1人1人違った道があってもいいではないか」という意見を発端に、グループメンバーが賛同。自分の得意分野や興味のある分野を生かした目標を立てることでもっともっと成長を促せるのではないかと考えた。
上級者臨床研究コーディネーター養成研修終了後、賛同いただいた7施設の皆様と中堅CRCの教育プログラムを作ることを計画。28名の中堅CRC(3年目以上の賛同者)とプログラムを始動させるに至った。
今回、プログラムの内容と結果について状況共有すると共に、どの施設でも使用可能なプログラムを目指すにあたり、是非全国のご施設の皆様と一緒に「中堅CRCの教育」について考えていきたい。中堅CRCだけではなく、中堅CRCを指導する立場の上級CRCの皆さんはCRCの土台を作ってきた年代の方々が多く、試行錯誤しながら自らCRCの道を切り開いてきたが多いのではないでしょうか。だからこそ日常業務追われ、目標のない中堅CRCをどう導き、指導していくべきか悩むことも多いと考えます。そんな上級CRCの方へのヒントにもなればと考える。
~中堅CRCの皆さん!自分の可能性を考えませんか。指導者の皆さん!中堅CRCを導いていきませんか~
演者:小島 美樹子(広島大学病院 広島臨床研究開発支援センター)
演者:川村 裕美(国立研究開発法人 国立がん研究センター 東病院)
演者:木村 雪絵(国立研究開発法人 国立がん研究センター東病院)
演者:佐々木 由紀(北海道大学病院 臨床研究開発センター)
「サステナブルな職業であり続けるために大切なこと〜マネジメント編〜
悩める中間管理職の解決の糸口〜皆が長くお仕事できる環境づくりを考える〜」
[連携企画
●事前教育オンデマンド配信:「職場におけるメンタルヘルスの取り組み~自分も周りも大切にするコミュニケーションを目指して~」
●シンポジウム2:「CRCがサステナブルな職業であリ続けるために必要なこと~環境・教育編~]
9月18日(日) 13:00~15:00
第3会場 朱鷺メッセ 新潟コンベンションセンター2F(メインホールB)
座長:石橋 寿子(第一三共株式会社)
座長:古屋 由加(広島大学病院 臨床研究開発支援センター)
パネリスト:大澤 智子(独立行政法人 医薬品医療機器総合機構 安全性情報・企画管理部)
COVID-19の蔓延で、多くの国民がワクチンの承認を待ち望み、治験の恩恵に触れた。COVID-19対策と医療の発展は、私達に大きな恩恵をもたらしたが、同時に新たな課題とも向き合い続けている。病と闘う患者さんの希望となる、そんな医療の発展に貢献したい。私達の闘いは、いったいいつまで続くのだろうか。医療も、我々を取り巻く環境も、これからも変化しつづけていくだろう。目の前の患者さんに向き合い、未来の患者さんへの架け橋となりたい。未来でも、Sustainableなプロフェッショナルとして、スタッフが働き、チームとなり機能する。適切な業務配分や、本人のモチベーションや強みを業務に活かせると理想的。だけど、なぜか偏る業務量。働き方改革って言うけれど、スタッフも、自分自身も、心と体の健康を大事にして一緒に働き続けていけるのだろうか。スタッフ自身が手に入れた知識とスキルと経験と、モチベーションも一緒にサステナブルでありたいけれど、時には「少し休みたい」「もう辞めたい」と思うこともある。CRC になってから、どんなことを乗り越え、何を励みに、どんなサポートがあって今に至るのか。そんな場面を振り返りながら、スタッフや中間管理職が抱えている課題をテーマにパネルディスカッションを進めていきます。
CRC、CRA、規制当局等で中間管理職の経験者、またはチームメンバーとしての立場及びメンタルヘルスの専門家に登壇して頂き、解決の糸口をみんなで探りたいと思います。職種、役職は不問です。最近この業界に飛び込んだばかりの新人の皆様も、ちょっと覗いてみてください。先輩や上司がどんなスタッフ支援と、職場環境を思い描いているのか。「お休みする意味やコツ」ってあるのか。皆さんにとってのサステナブルを見つめ直す時間となれば幸いです。
演者:古屋 由加(広島大学病院 広島臨床研究開発支援センター)
演者:山﨑 純子(神戸大学医学部附属病院 臨床研究推進センター 研究実施部門)
演者:福原 視美(長崎大学 保健センター(こころとからだの健康相談室))
ナビゲーター:小林 久子(大阪大学医学部附属病院 未来医療開発部 臨床研究センター)
「日本の治験審査委員会はこのままで良いのか? ~治験審査委員会が抱える問題~」
9月18日(日) 9:00~11:00
第5会場 朱鷺メッセ 新潟コンベンションセンター3F(中会議室301)
座長:近藤 智子(鹿児島大学 ヒトレトロウイルス学共同研究センター)
座長:関根 恵理(ノバルティス株式会社)
パネリスト:川名 純一(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
治験以外の臨床研究では、審査の中央化が進み、CRB(Certified Review Board) のように体制整備が進んでいる。一方、治験審査委員会(以下、IRB)は、2008年3月のGCP省令改正により共同IRBや中央IRBでの審査が可能となったが、未だ十分な普及にはつながっていない。関連病院に設置された中央IRBや、大規模な医療機関が自施設のIRBを中央IRB化することはあっても、限局的な利用であることが多い。IRBが中央化すれば、1) 審査費用が抑えられる、2) 少数精鋭のIRB に集約され審議の質が向上する、3) 治験依頼者・実施医療機関ともに業務負担が減り効率化が進む、という日本の治験促進に多大なメリットがあると考えられる。
しかし、日本ではIRB を評価・認定する基準がなく、実施医療機関にとってはどの中央IRB に審査依頼すべきかの判断が難しい。治験を多数受託している大規模施設では自施設のIRB で審査した方が効率的であるが、一部を中央IRBに依頼して「治験毎にIRBが異なる」という状況になるのは合理的ではない。さらに、IRB委員の研修には公的なものがほとんどなく、各施設に任されているのが現状である。IRBの質の担保も問題である。
日本において、治験依頼者、実施医療機関、そして被験者がともに望むIRBのあるべき姿とはどのようなものか。今のIRBが抱える問題点から、本当に必要とされるIRBのあるべき姿について議論したい。
演者:五百蔵 武士(神戸大学医学部附属病院 臨床研究推進センター)
演者:関根 恵理(ノバルティスファーマ株式会社 グローバル医薬品開発本部 トライアルモニタリング)
演者:稲野 彰洋(福島県立医科大学附属病院 臨床研究センター)
演者:山本 洋一(大阪大学医学部附属病院 未来医療開発部 臨床研究センター)
「医師主導治験・特定臨床研究を推進する意義と望まれる実施体制」
9月18日(日) 9:00~10:30
第7会場 朱鷺メッセ 新潟コンベンションセンター4F(国際会議室)
座長:樽野 弘之(公益財団法人 がん研究会有明病院 先進がん治療開発センター 審査管理部兼臨床試験支援部 CRC室)
座長:肥田 典子(昭和大学薬学部 臨床薬学講座・臨床研究開発部門/昭和大学臨床薬理研究所)
2003 年に薬事法( 現・医薬品医療機器等法) が改正され、製薬企業等と同様に医師自ら治験を企画・立案し、治験計画届を提出して治験を実施できるようになった。また、2017年に臨床研究法(平成29年法律第16号)が施行され、一部の介入研究(以下、特定臨床研究という。)において法規制が敷かれることとなった。医師主導治験や特定臨床研究を含むアカデミア発の臨床研究は、各種規制に合わせて関連する通知や具体的な運用に関するQ&A 等も随時発出されているものの、潤沢な資金が確保できないなどの理由からリソースの確保が困難な場合も多く、課題は散見する。しかし、医師主導治験が遵守すべきはGCP省令であり、基本的なタスクは企業治験と同様に組む必要があり、資金に見合ったタスクの削減あるいは役割分担を考えることが求められている。一方、特定臨床研究等では法規制の違いはもちろんのこと、「薬事承認」を目的とした治験とは異なり、求める品質管理・品質保証の範囲は幅広いため「基本的なタスク」が定まっていない。そのため、『何を』『どこまで』支援すべきなのか、線引きに悩むケースが多い。
本シンポジウムでは円滑にアカデミア発の臨床研究等を推進・支援するための課題及び対応策について、院内外含めて様々な研究支援の立場から検討をおこなう。
演者:樽野 弘之(公益財団法人 がん研究会有明病院 先進がん治療開発センター 審査管理部兼臨床試験支援部 CRC室)
演者:大村 美幸(順天堂大学医学部附属 順天堂医院)
演者:南 学(国立研究開発法人 国立循環器病研究センター データサイエンス部)
演者:樋口 和奈(株式会社アイロム クオリティマネジメントセンター 人財開発部)
「研究グループにおけるPPI(患者・市民参画)の実践」
9月18日(日) 13:00~15:00
第7会場 朱鷺メッセ 新潟コンベンションセンター4F(国際会議室)
座長:天野 慎介(一般社団法人 全国がん患者団体連合会)
座長:小村 悠(国立研究開発法人 国立がん研究センター東病院 臨床研究支援部門 研究企画推進部研究推進室)
国の第3 期がん対策推進基本計画では、「治験、臨床試験に関する計画立案の段階から、研修を受けた患者が参画することによって、患者視点のアウトカムの提案や、患者のリクルートの適正化等をより高い精度で進めていくことの必要性が指摘されている」としたうえで、「AMED は、海外の研究体制と同様、我が国でも患者やがん経験者が研究のデザインや評価に参画できる体制を構築するため、平成30(2018)年度より、患者及びがん経験者の参画によって、がん研究を推進するための取組を開始する。また、国は、研究の計画立案と評価に参画可能な患者を教育するためのプログラムの策定を開始する」とされ、AMEDにおいて「患者・市民参画(PPI)ガイドブック」が公開されるなど、がん医療やがん研究へのPPI(患者・市民参画) が推進されつつある。また、国内のがん領域に関わる主要な研究グループにおいても研究の計画や評価の段階から患者の参画を得て、患者の声を研究に反映させる取り組みが拡がっており、加えてがんゲノム医療の進展に伴い、PPIの必要性はさらに高まっている。
当シンポジウムでは、PPI を積極的に実践している国内のがん領域に関わる主要な研究グループやがん患者団体における実践例を共有し、今後のPPI推進にあたっての参考とすることを目的とする。
演者:武藤 香織(東京大学 医科学研究所 ヒトゲノム解析センター 公共政策研究分野)
演者:中村 健一(国立研究開発法人 国立がん研究センター中央病院)
演者:吉野 孝之(国立研究開発法人 国立がん研究センター東病院 医薬品開発推進部門)
演者:長谷川 一男(日本肺がん患者連絡会)
市民公開講座
9月17日(土) 16:00~17:30
第2会場 メインホールA
座長:大澤 智子(独立行政法人 医薬品医療機器総合機構 安全性情報・企画管理部)
座長:小林 久子(大阪大学医学部附属病院 未来医療開発部 臨床研究センター)
2020年にはじまった「今までとは違う世界」。
当たり前だと思っていたことが当たり前でなくなり、
当たり前でなかったことが当たり前になりつつある今。
2020年1月、日本で初めて新型コロナウイルスに関連した肺炎の患者さんの発生が確認され、決定的な解決策が打ち出せない中、未知の感染症の脅威は日本全国に広がりました。
2021年2月、医療従事者への新型コロナウイルスワクチン接種が始まり、2021年12月には新型コロナウイルス感染症治療薬が特例承認され、保険を使って使用できるようになりました。その間、国を挙げての2回のワクチン接種も進められました。 2022 年5 月、長期間欠かせなかったマスクの着用について、ついに「屋外では距離( 目安2m) を確保できず会話をする場合を除き不要、屋内でも2m以上の距離を確保できほとんど会話を行わなければ不要」との政府見解が示されました。ワクチンについては3回目接種を終えた人が7000万人を超え、4回目接種も始まりました。重症者数の推移から、予防のためのワクチン接種の効果もうかがわれます。とは言え、入院患者数、ICU患者数が劇的に少なくなっているわけではなく、新規感染者数は高止まりともいえる状況です。
私たちはいつの間にかコロナとともに生活しています。安心して生活を続けていくためには、基本的な感染予防に加えて、
・より積極的な予防、治療のためのくすり
・新しいくすりの開発
・これらをめぐる正しい情報…などが必要ではないでしょうか。新しいくすりを使えるようにするために必ず行わなければならないのが「治験」です。
今回は、新型コロナウイルス感染症のこと、これまでと違う世界で私たちにできること、よく目にするようになった「治験」などについて、「今聞きたい!知りたい!」ことを、専門家から皆様へわかりやすくお伝えします。また、治験に欠かせない職業の一つである「CRC」について、より多くの方に知っていただけるよう、ちけん君(日本医師会治験促進センターのキャラクター)と一緒にご紹介します。
演者:忽那 賢志(大阪大学大学院 医学系研究科 感染制御学講座)
演者:黒川 友哉(千葉大学医学部附属病院 臨床試験部)
演者:大澤 智子(独立行政法人 医薬品医療機器総合機構 安全性情報・企画管理部)
演者:野田 香苗(地方独立行政法人 東京都健康長寿医療センター 健康長寿イノベーションセンター)
ポスター連動企画
~小さなアイデアも大歓迎~
9月17日(土).18日(日)
ポスター展示:第1会場 朱鷺メッセ 新潟コンベンションセンター1F(展示ホールB)
*各演者の発表はオンデマンド配信で 9月10日〜10月31日 視聴いただけます。
9月17日(土) 16:00~18:00
パネルディスカッション:第4会場 朱鷺メッセ 新潟コンベンションセンター 2F(中会議室201)
パネルディスカッション部分 現地開催のみ、オンデマンド配信なし
あり方会議発足当時のように、研究発表ではない日常行っているちょっとした工夫をご発表いただきます。一般演題のように目的や方法という枠組みにとらわれることなく、日頃の業務の中でどのような工夫や、改善を行っているかアイデアを持ちより臨床試験に取り組む仲間と共有してみませんか?
座長:小宮山 靖(ファイザーR&D合同会社)
座長:石橋 寿子(第一三共株式会社)
●このセッションの趣旨
品質マネジメントの重要性について議論をはじめて10年を超えて年月が経ちました。しかし長らく「なぜそれが必要なのか」や理論的なことの講義や紹介があっても臨床試験の具体的な実務に落とし込んだ解説や発表などはなく机上の空論に終始したこともあり、各施設レベルで根付きにくい時代が続きました。
その後、各施設から少しずつ具体的な取り組みや製薬協等からも具体的な取り組みの紹介がなされ、さらにICH-GCPの改訂などを契機に、ようやくここ2-3年で各施設において「自分の施設ではどのようにしていこうか」を考えるようになったり、各学会やWSでも品質マネジメントに関しての演題も増えてきました。
CRCと臨床試験のあり方を考える会議2011岡山で、データの品質管理「治験データの質は施設の質で決まる!~さてどうする?」というセッションを当時CRCだった石橋寿子座長で、小宮山靖演者にて開催しました。その際に「『自分の施設の品質の作りこみについてあり方会議で各施設が発表しあうようになれば、日本の底力を世界にアピールできる、そのような時代になることを望む』」と演者の小宮山靖が熱弁して11年たった今、ようやくそれが実現しようとしています。
各施設における品質の作りこみのために工夫していること(被験者の安全性を確実に守るための工夫、プロトコル逸脱を防ぐ工夫、逸脱等が起こったとき再発を防ぐ取り組み、予定通り被験者リクルートするための取り組み、検査キットの管理の工夫等、なるべく、他のCRCも真似できそうな、予算のかからない仕組みや取り組み)を紹介しあい意見交換をしあう場を設けることにしました。
他施設の工夫を聞くことで次につながるハッと気づくアイデアがたくさんが生まれるはずです、プラスのスパイラルを発生させたいと思います。
●当日は、発表者全員がパネリストとなりディスカッションを行います。
発表形式
①各演者がオンデマンドで発表(e-Posterも公開 9月10日〜10月31日)
②現地会場にポスター掲示(会期中掲示)
③パネルディスカッション
座談会
「臨床試験・治験、そしてCRCとCRAの相互理解を目指して」
私たちを取り巻く環境の変化(regulation、ICTの活用等)に伴い、CRCやCRAが通常行っている業務が変化しています。CRCやCRAが十二分に意見を重ねることが難しくなっている今、それぞれが抱える日常の疑問や困っていることを、色々な角度からの意見を交換して問題の理解と解決策を模索したいと考え、座談会を企画しました。
第1部では「コロナ禍における業務の実際」「グローバル試験」、第2部では「原資料」「日々の業務の工夫」「スタッフへの教育」をテーマとし、事前にいただいた事例やご質問を共有・議論いたします。
医療機関側、治験依頼者側から、双方の現状を理解し、創薬育薬をはじめとした医療の発展に何をすべきなのか、ともに考える機会にしませんか?
9月17日(土) 10:00~11:00
第4会場 朱鷺メッセ 新潟コンベンションセンター2F(中会議室201)
9月18日(日) 13:30~14:30
第4会場 朱鷺メッセ 新潟コンベンションセンター2F(中会議室201)
座長:榎本 有希子(日本大学医学部附属板橋病院 臨床研究センター)
座長:飯島 雅之(中外製薬株式会社 臨床開発本部)
パネリスト:麦島 麻帆(株式会社アイロム)
パネリスト:羽田 かおる(独立行政法人 国立病院機構 大阪医療センター 臨床研究センター 臨床研究推進部 臨床研究推進室)
パネリスト:花島 孝之(ノバルティスファーマ株式会社 トライアルモニタリング)
パネリスト:玉盛 明子(中外製薬株式会社 臨床プロセス戦略部)
パネリスト:吉見 尚人(エイツーヘルスケア株式会社 オンコロジー臨床開発第2部)
「どうしたらいいんだろ? そうだ、PMDAに聞いてよう!」
[連携企画
●事前教育オンデマンド:E10 治験とGCP、適合性調査のベーシックガイド]
※1~3年新人対象
※本お悩み相談コーナーの質問事項は事前登録制です。
9月17日(土) 14:20~15:50
第4会場 朱鷺メッセ 新潟コンベンションセンター2F(中会議室201)
最近治験に関わりはじめた皆さんへ
治験って、GCPって、PMDAって、よくわからないなって感じることありますよね。
わかります、いつも感じている疑問や悩みや気になることもきっとあると思います。
そんな治験1~3年生の皆さんの疑問やお悩みをPMDAの調査員がきっと解決します。
治験とGCPやPMDAについての復習講義を聞いたあと、信頼性調査(適合性調査)の経験が豊富なPMDAの調査員にいろいろ質問、相談してみてはいかがでしょうか。
座長:富安 里江(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
座長:川名 純一(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
相談員:岡崎 美聖(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
相談員:下野 航(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
相談員:富安 里江(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
相談員:川名 純一(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
下野 航(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
演者:岡崎 美聖(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
ワークショップ
「リスクに基づく臨床試験の品質管理において、医療機関とSponsorに求められる役割を考える」
[連携企画
●事前教育オンデマンド:E6新しいICHガイドラインに即した臨床試験の品質の考え方とその実現に必要なこと]
9月18日(日) 9:00~11:00
第4会場 朱鷺メッセ 新潟コンベンションセンター2F(中会議室201)
座長:實 雅昭(日本製薬工業協会 医薬品評価委員会 臨床評価部会)
座長:森山 菜緒(帝京大学医学部附属病院 臨床試験・治験統括センター)
ICH-E6(R2) に品質マネジメントやリスクに基づくアプローチによるモニタリングなどが盛り込まれたことを受け、GCPガイダンスでは品質マネジメントシステム(Quality Management System: QMS)の履行が治験依頼者の責務として明記された。加えて、効率的・革新的な品質確保の取り組みを奨励する「治験における品質マネジメントに関する基本的考え方について」が発出され、「リスクに基づくモニタリングに関する基本的考え方」が改めて示された。
これらにより臨床試験の質は、従来のモニタリング( 出口管理) による確保から、プロセスによる確保へと転換が求められ、医療機関がリスクに基づく考え方でプロセスを管理することが重要となってきた。またICH-E8(R1) では、計画とプロセスの設計で質を担保するQuality by Designの概念が取り入れられ、医療機関とSponsorが一体となり質を作り上げていくことがより重要となる。
つまり臨床試験に対するQMSは、Sponsorが履行するだけでは完全ではなく、臨床試験の現場とのすり合わせが重要となってくる。医療機関側でも、従来医療安全管理として浸透していたQMSを、臨床試験でも履行する取り組みが盛んになった。
本ワークショップでは、医療機関とSponsorそれぞれのQMSのあり方を整理し、CRC及びCRAから臨床試験の現場での取り組み事例を紹介いただいた上で課題や改善点について議論し、それぞれに求められる役割の再認識と、現場に持ち帰れる具体策を手に、自らによる臨床試験の質確保への取り組みを体感することを目指す。
演者:松山 琴音(日本医科大学 医療管理学)
演者:森山 菜緒(帝京大学医学部附属病院 臨床試験・治験統括センター)
~“意思決定”の精度向上のためにCRAにもできること~
演者:森田 陽(帝人ファーマ株式会社 臨床開発部)
ファシリテーター:後藤 美穂(トライアドジャパン株式会社 医薬開発本部)
ファシリテーター:出合 美帆(北海道大学病院 臨床研究開発センター サイトマネジメント室)
ファシリテーター:佐久間幸子(北海道大学病院 臨床研究開発センター サイトマネジメント室)
ファシリテーター:老本名津子(京都大学医学部附属病院 先端医療研究開発機構 臨床研究支援部)
ファシリテーター:藤岡 慶壮(住友ファーマ株式会社 開発統括部)
ファシリテーター:篠原 貴(大鵬薬品工業株式会社 開発推進部)
ファシリテーター:酒井 優(MSD株式会社 スタディオペレーション部 オンコロジー領域)
ファシリテーター:阪井田雅昭(アストラゼネカ株式会社 臨床開発統括部)
「ワークショップで体験しよう!―「シンポジウム:臨床研究支援のこれからのあるべき姿を見据えて」実体験版 ―」
[連携企画
●シンポジウム3:「臨床研究支援のこれからのあるべき姿を見据えて―」]
9月18日(日) 13:00~15:00
第5会場 朱鷺メッセ 新潟コンベンションセンター3F(中会議室301)
司会:桃井 章裕(慶應義塾大学病院 臨床研究推進センター)
司会:成田 さわな(熊本大学病院 臨床試験支援センター)
総評:岩﨑 幸司(大阪大学医学部附属病院 未来医療開発部 臨床研究センター)
現場で培ってきたCRCやMonitorの経験や視点は、これからの臨床研究にどのように活きるのであろうか。これからの臨床研究支援のあるべき姿とは?我々は1日目の関連するシンポジウムで、実現性と品質の高い研究計画書の作成には、研究計画早期から多職種(PI、PM、CRC、Monitor、DM、STAT、倫理担当者)協働によるコンピテンシーの融合が有用であることを紹介した。しかしながら、シンポジウムを聴講された方々は、自身のキャリアを、どの時点から、どのように研究計画立案に活かすことができるのか具体的にイメージするには至っていないのではないのではないだろうか。そこで、研究支援者を対象として、AMED事業班で作成されたプログラムの一部を体験いただけるワークショップを企画した。ご承知のように、十分に練られていない研究計画書は多くの逸脱又は不適合を引き起こし、研究の信頼性と研究対象者の安全性を脅かし、それに伴う事後対応により現場を疲弊させてしまう一因となっている。このような状況を本質的に解決するためには、研究過程の上流である研究計画立案の段階に介入し、研究計画書に多職種の視点に立ったリスク低減策を盛り込んでしまうことである。本ワークショップでは、研究計画骨子(シノプシス)を題材に、自身の職種の盲点、異なる職種の意見や知恵の効用、多様な視点がもたらすアイディアの創出を体感いただきたいと考えている。未来の医療創出のために研究支援者に求められる新たな役割を認識いただき、臨床研究ならびに各々のキャリアの新たなステージへの第一歩のきっかけとなれば幸いである。
●ファシリテーター
| 氏名(所属) | ワークショップにおける役割 | |
|---|---|---|
| 1 | 真田 昌爾(神戸大学 医学部附属病院 臨床研究推進センター) | 研究者 |
| 2 | 西﨑 祐史(順天堂大学 医学部 医学教育研究室/順天堂大学医学部附属順天堂医院 臨床研究・治験センター) | 研究者 |
| 3 | 山口 拓洋(東北大学大学院医学系研究科) | 統計家 |
| 4 | 髙田 宗典(東北大学病院臨床試験データセンター) | データマネージャー |
| 5 | 松嶋 由紀子(慶應義塾大学病院 臨床研究推進センター) | モニター |
| 6 | 岩﨑 幸司(大阪大学医学部附属病院 未来医療開発部 臨床研究センター) | スタディーマネージャー |
| 7 | 南 学(国立研究開発法人 国立循環器病研究センター データサイエンス部) | 研究者 |
| 8 | 松本 紘毅(順天堂大学医学部 循環器内科学講座) | 研究者 |
| 9 | 肥田 典子(昭和大学薬学部臨床薬学講座・臨床研究開発部門/昭和大学臨床薬理研究所) | スタディーマネージャー |
| 10 | 大村 美幸(順天堂大学医学部附属順天堂) | スタディーマネージャー |
| 11 | 浅田 隆太(国立大学法人 東海国立大学機構 岐阜大学医学部附属病院 先端医療・臨床研究推進センター) | スタディーマネージャー |
| 12 | 久保田 有香(群馬大学医学部附属病院 臨床試験部) | モニター |
「コミュニケーションスキルを磨こう! ~やわらかな1.5人称とメタ認知~」 〔参加体験型〕
座長:中野 重行(一般財団法人臨床試験支援財団 研修委員会)
座長:有田 悦子(一般財団法人臨床試験支援財団 研修委員会)
10月1日(土) 13:00~16:00 ZOOM配信(財団)
チームプレーヤーの間で『よきコミュニケーション』が生まれることは、「創薬育薬医療チーム」のパフォーマンスを高めるための必須条件です。「創薬育薬医療チーム」は、CRC、CRA、患者、医師などを含む、幅広い範囲で働く多職種により構成されています。そこでは、コミュニケーション能力が特に重要になってきます。 本ワークショップでは、『よきコミュニケーション』のイメージを頭に描き、そのために必要なスキルを身につけるために行います。今回のテーマは、『やわらかな1.5 人称』というコンセプトと俯瞰的視点である『メタ認知』です。1 人称の「わたし」と2 人称の「あなた」の間を、自由に行き来できるというイメージを実践するのに役立つ「メタ認知力」の向上を取りあげます。「メタ認知力」が身につくと、セルフモニタリングにつながり、セルフコントロールにも役立ちます。 臨床試験支援財団主催のコミュニケーションに関するワークショップは、これまでに、CRCあり方会議の期間中に4回実施してきました。今回も昨年に引き続き、Zoomを使って実施します。
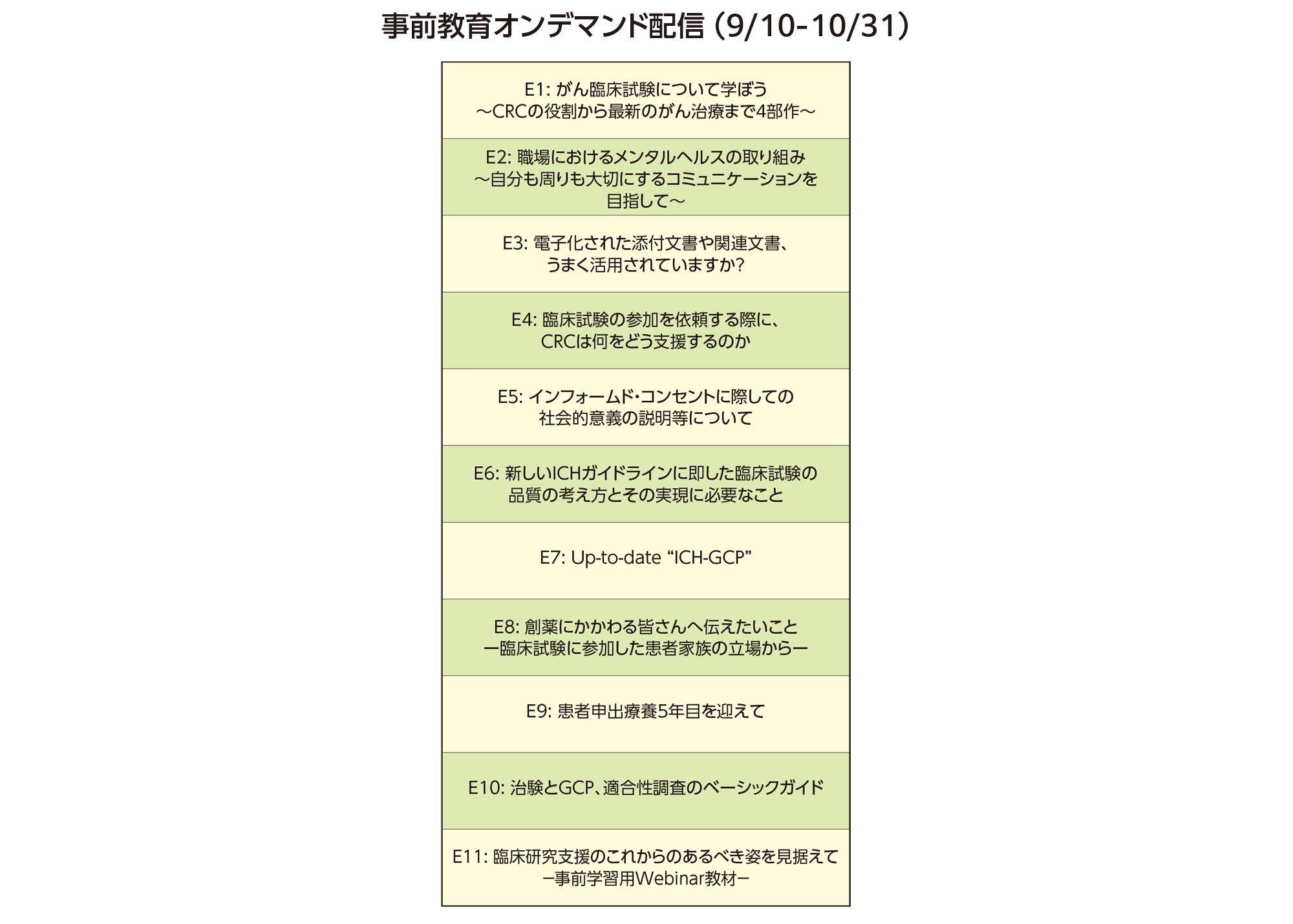
事前教育オンデマンド配信
※シンポジウムなどの前に見ていただき、知識を整理するためのコンテンツを作成しました。
9月10日(土)より公開しますので、実地開催プログラムの前にご覧ください。
日本人の2人に1人が、がんになり、3人に1人はがんで亡くなる現在。国内のがん患者数は年々増加しています。そんな中がんの新たな診断・治療技術は日々研究が重ねられています。現在がん臨床試験は臨床試験全体の50%以上といわれています。しかしがん領域の臨床試験は、特有の評価や知識が必要なこともあり、がん臨床試験に携わったことのないCRC からは「大変そう」「難しそう」「がんの臨床試験には携わりたくない」と思われることも少なくありません。確かにがん領域の経験が長いCRC でもがん臨床試験の特殊性は、アセスメントに戸惑うことが多いのが現状です。また最近のがん臨床試験では複雑なプロトコールやこれまでの治験体制では対応できない試験も増えてきています。がん臨床試験に携わったことがあるCRCや施設であっても、不安に思われることや、施設全体で一から体制を作り上げていかなくてはいけない場面も少なくありません。がんに対する治療薬等のドラッグ・ラグ、デバイス・ラグを少しでもなくし、薬を待つ患者さんに1 日でも早く薬を届けるために、そして安全にがん臨床試験を行うために、私たちCRCの力や、努力が不可欠です。本セッションでは、
*はじめてがん臨床試験に携わるCRCに求められる役割(E1-1)
*最新のがんの臨床試験にフォーカスし、進化し続けるがん治療や臨床試験の情報(E1-2)
*医療機関に求められる体制構築(E1-3)
*次世代の臨床試験デザインとて注目されている「マスタープロトコル」の理解のために必要な知識と実践(E1-4)
の4 つのPoint について、教育オンデマンドをお願いしました。講師の皆様は第I 相試験を中心にご活躍されている先生方です。オンデマンド配信となりますので、これからがん臨床試験に携わってみたいと思っている方はもちろん、最新のがん治療について学びたいと思っている方などたくさんの皆様に繰り返し聴講いただければと思います。これを機に、がん臨床試験をあらためて勉強してみませんか。
演者:西岡 晶子(独立行政法人 国立病院機構 四国がんセンター)
現在、がんによる死亡が日本人の死因の第1位を占めている。早期発見されれば5年生存率は高いが、病期が進むにつれ治療成績は芳しくない。
しかし近年、新規抗がん剤が次々と開発され、進行期のがんでも長期生存が望める時代がやってきた。例えば、がん細胞に特異的に作用する分子標的薬、人間の持っている免疫機能を利用して効果を発揮する免疫チェックポイント阻害薬、患者の遺伝子変異を調べてオーダーメイドの治療を提供するがんゲノム医療等、治療の選択肢は確実に増えている。
これら新規抗がん剤の開発には質の高いデータが求められており、CRCへの期待は大きい。
一般的に抗がん剤の治験は、それ以外の薬剤の治験より難しいと言われている。それにはいくつかの理由が考えられる。
まず一つには、がんが難治性疾患であることである。進行すれば生命に関わる疾患であるため、死への不安や原疾患に伴う症状への苦痛がある患者が対象であることを理解しておかなければならない。
次に抗がん剤の特徴についての知識が必要である。一般薬に比べると、抗がん剤は治療域が狭いのが特徴である。薬剤投与量が少なければ効果に乏しく、多過ぎると重篤な副作用を引き起こす。そのため抗がん剤治験のプロトコールは、緻密で複雑な投与・観察スケジュールが設定されている。安全に治験を進めるためには、プロトコールからそれらを読み取り、実践に繋げる能力が求められる。
そして、有害事象が必発する抗がん剤の治験では、安全性評価にCTCAEと呼ばれる有害事象共通用語基準が使用される。被験者に出現している症状を察知してCTCAEと照合し、担当医師と共に事象名、グレードを評価し、プロトコールに準じた的確な対応をする能力が必要である。
また、有効性の評価にはRECISTガイドラインが使用される。これは固形がんの効果判定の世界標準であり、抗腫瘍効果を正確に判定するには、RECISTを用いた評価方法を正しく理解しておくことが必要である。
最後に、評価項目に全生存期間が含まれている治験の場合、数年に渡る長期間の追跡調査が必要になることがある。そのため患者本人はもちろん、家族とも良好なコミュニケーションを図れる人間性も大切である。
がん領域での治験には、これらの能力を兼ね備えたCRCの存在が重要である。今後も抗がん剤の新規開発や個別化医療が進み、CRCの果たす役割は益々大きくなると予想される。
演者:土井 俊彦(国立研究開発法人 国立がん研究センター 先端医療開発センター/東病院 先端医療科)
がんゲノム医療による個別化医療の加速は治療の最適化を向上させてきたが、新薬開発においては多くの新規承認薬剤がオーファン化する傾向にある。同時に、遺伝子やバイオマーカーに基づく臨床試験は、大規模スクリーニングが付随した第3相試験をおこなう治験に加えてバスケット型やアンブレラ型試験、RWD/RDEに基づいた治験での早期承認をめざす治験も増えてきている。同時にコロナ下、ポストコロナ下での新しい治験形態としてDCTによる治験の効率化やエコ化が進んでいる。その中で新規薬剤はバイオテック技術を用いたプラットホーム型創薬によりファーストインクラスの薬剤開発として、再生細胞、遺伝子治療、アイソトープ医薬品、核酸医薬品、武装化抗体(ADC 光免疫 Theranoticus)など従来とは異なるマネジメントが必要な創薬が進みつつある。いくつかの新しいクラスの開発の状況を紹介しながら、治験の変化や多様性について提示し、将来のありかたについて示してみたい。
演者:中濱 洋子(国立研究開発法人 国立がん研究センター中央病院 臨床研究支援部門)
がん臨床試験に参加するがん患者は、自分自身のがんの治療法として臨床試験を選択します。私たちCRCは、臨床試験を通して、個々の患者に合わせた最善のがん医療の提供の場に立ち会い、他職種とともに適切に臨床試験を実施できるよう、医療機関全体を調整していくことが主な役割です。それは、患者の安全を守り、将来のよりよい治療をいち早く届けることにつながります。
昨今の抗悪性腫瘍薬の開発の傾向は、がん腫別から遺伝子別へ個別化がすすみ、実施計画書の形態の変化(例えば、第1相試験の拡大コホートの設定やマスタープロトコルなど)、開発から承認までの時間が高速化し、国際共同試験が定番です。つまり、早いスピードの実施を求められるうえ、複雑化しています。また、臨床試験を経て新治療法が承認されることで、通常診療の様子も変化しています。例えば、免疫チェックポイント阻害剤を用いた治療法、特定の遺伝子変異を対象にした治療、免疫細胞療法などにより、投与方法、意思決定支援、遺伝子検査、副作用のアセスメント、緊急時の体制、社会的サポートなどの変化です。そのため、臨床試験に限らず、通常診療においても体制整備を行っている医療機関が多いのではないでしょうか。逆に、臨床試験実施医療機関では、先に行った臨床試験で構築した実施体制を、承認後の通常診療に活用していることもあります。
本セッションでは、がん臨床試験を実施するために医療機関が整えておいたほうがいい仕組みはどういうものがあるのか、そしてその体制を整えるために医療スタッフを巻き込む工夫などについて、考えてきたいと思います。
演者:安達 聖子(国立研究開発法人 国立がん研究センター東病院 臨床研究支援部門 臨床研究コーディネーター室)
革新的な技術開発に伴い、Next-generation sequencing(NGS)の開発、それに伴い2018年より厚生労働省からがんゲノム医療推進に対する取り組みが開始された。日本においても2019年6月からがん遺伝子パネル検査が保険適用され、2021年8月からはリキッドバイオプシーも保険適応となり、今後さらに個別化医療が進むことが期待されている。近年、NGSの結果に基づいた治療をより早く患者へ届けるために、特定のバイオマーカー(がん遺伝子変異等)に対する臨床試験が積極的に行われている。
これらの臨床試験では、同一プロトコル内で、特定のがん種(単一/複数)と関連するバイオマーカー、対する治療薬(単一/複数)について評価するデザインが用いられることが多い。これらの臨床試験で用いられるプロトコルは「マスタープロトコル」と称され、臨床試験デザインとして開発の効率化が期待されている。マスタープロトコルは、アンブレラ、バスケット、プラットホーム試験に分類される。これらの試験を実施するためには、疾患、標準療法など様々な知識が必要となる。
また、がんゲノム医療だけでなく、新たな作用機序を持つ薬剤として抗体薬物複合体(ADC)の開発も活発であり、従来より行われてきたIHC(免疫染色)をバイオマーカーとした開発も、同様の方法での開発が利用されている。 本セッションでは、抗がん剤領域における最新の臨床試験デザインについて以下の内容を中心に解説する。また、最新の臨床試験デザインについての理解を深めると同時に、CRCの役割や国立がん研究センター東病院における実施体制の紹介、実施する上での課題などを検討したい。
1)マスタープロトコルについて
- アンブレラ試験
- バスケット試験
2)バスケット試験を例示とし、医療機関における実施体制の紹介
- 試験開始前におけるプロセス
- 試験実施中におけるプロセス
- 関連部門との連携
3)CRCの立場から
- がん遺伝子パネル検査について
- 次世代のがん臨床試験におけるメリット、デメリット
演者:福原 視美(長崎大学 保健センター(こころとからだの健康相談室))
COVID-19の蔓延で、多くの国民が治験の恩恵に触れると同時に、我々は新たな課題とも向き合い続けている。医療も、我々を取り巻く環境も、これからも変化しつづけていくだろう。
目の前の患者さんに向き合い、未来の患者さんへの架け橋となりたい。未来でもSustainable なプロフェッショナルとして、スタッフも、自分自身も、心と体の健康を大事にして一緒に働き続けていけるのだろうか。時には「少し休みたい」「もう辞めたい」と思うこともあるだろう。そんな時、「こんな風に考えていいのか」「自分が弱いから、ネガティブに思うのか」と自問し、苦しくなることはありませんか。本On Demandでは、メンタルヘルスの専門家の福原視美先生により、自分も相手も「思いやる」コミュニケーションをテーマに、基本的な考え方、捉え方についてご講演頂きます。連動企画である、『サステナブルな職業であり続けるために大切なこと(マネジメント編)』にご興味のある皆様。是非とも、事前に聴講して頂き、シンポジウムで、福原視美先生に困っていることを質問したり、相談してみませんか。本On Demand配信は、職種、肩書き、経歴は不問です。シンポジウムの事前準備として、福原先生が、分かりやすく(聴きやすく)、テーマを紐解き、教えてくださいます。
演者:沼田 恵理(独立行政法人 医薬品医療機器総合機構 安全性情報・企画管理部)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)の改正により、2021年8 月から、これまで医療用医薬品・医療機器などの製品に同梱されていた紙の添付文書は原則として廃止され、電子的な方法で添付文書を閲覧することが基本となりました。これに伴い、医薬品等の外箱等に表示されたGS1バーコードをスマートフォンやタブレットのアプリケーションを使って読み取り、その情報をもとにインターネットを経由してPMDAのホームページに掲載されている最新の添付文書、また関連文書にアクセスすることができるようになっています。電子的な情報、皆さんはどのように活用されていますか?
今、添付文書や関連文書はどのような手順で閲覧できるのか、インターネットが使えなくなった時に備え、どのような対応が可能となっているのか、電子化された添付文書の一括ダウンロード機能など、今回新たに構築された仕組みやサービスとともにご紹介します。また、添付文書に記載された情報(注意事項等情報)をより活用しやすくするための取り組みとして、添付文書のXML化を進めています。添付文書を使用される医療従事者の皆様が閲覧しやすいように、通し番号の設定や、主要文献へのリンク設定など、様々な工夫をしていますので、併せてご紹介します。
演者:佐藤 恵子(京都大学大学院 医学研究科 社会健康医学系専攻)
患者が臨床試験への参加・不参加を決める際は、内容をよく理解して納得してもらう必要がある。CRCは、患者の自己決定を支援することが役割の一つであるが、何をどうすることが「自己決定を支援する」ということだろうか? 患者に臨床試験の内容を詳しく説明して理解してもらい、同意書に署名をもらえば、GCP上では問題にならない。リスクが小さい治療の場合はこれでよいことも多いが、治療が患者の生命や生活に大きな影響を及ぼす場合は、不十分である。本セミナーでは、患者に納得のいく選択をしてもらうために、CRCはどのような配慮が必要かについて、抗がん剤の治験を例に解説したい。
1) インフォームド・コンセントとは何か、なぜ必要かインフォームド・コンセントは、患者が医療について十分な説明を受け、理解した上で同意することである。医療は、患者に侵襲を与える行為であり、痛かったり苦しかったりするのは本人なので本人に決めてもらう、という当たり前なところに根拠がある。患者が決めるのは具体的な治療法ではなく、「治療を受けてどういう生活をしたいか」であり、医療者は、それを最もよく実現する方法を知識や経験を駆使して考えて提案する。したがって、治療の目的やリスク・利益などを説明したら、患者が「何を大事と思っているか、自分はどうあることをよしとするか」をよく聴き、専門家として最善と思われる治療を提案して話し合う、という過程が必要である。
2) 臨床試験の同意取得の際に、何が必要か臨床試験は、臨床上の未解決なことを確かめるために行うものであり、患者の身体を対象にさせてもらって、将来の患者のための知見を得ることが目的であり。したがって、対象者には、実験的な部分も含めて説明し、試験の意義を理解してもらった上で参加・不参加を決めてもらわなくてはならない。これには、「臨床試験をなぜ実施しているか、試験に参加したとき( またはしなかったとき)に、どうなるのか」という全体像を患者がイメージできるように説明した上で、患者の価値観を聴いて、何が患者の利益になるかを考えて話合うことが必要である。
演者:渡邉 達也(北里大学 医学部附属臨床研究センター 企画開発部門)
臨床研究は医療の発展のために必須であり、それを適切に行うことは全ての医療者にとって義務とも言える。臨床研究を考える上でまず明確にすべき点は、日常診療と異なる構造があることである。日常の診療では、それに伴う利益(治療効果等) や不利益(副作用等) は「診療を受ける患者自身」が受ける。一方、臨床研究では不利益は参加した被験者(「目の前の患者」)が負うが、利益は被験者本人に限定されず、むしろ臨床研究の目的は「将来の患者のため」に行われる行為であるため、「将来の患者」が享受することになる(将来の社会に対する利益)。このような構造的な違いがあるため、臨床研究を倫理的に適切な行為として正当化するためには、臨床研究のリスク・ベネフィットを慎重に評価し「研究の社会的意義」、「科学性の確保」および「被験者保護」という社会からの要請に適切に応える必要があり、その代表的なものがインフォームド・コンセント(以下、IC)である。
ICは原則的に臨床研究の責任/分担医師をおこなうが、臨床研究コーディネータがその説明を補助する場面も多い。ICに際して、研究の目的、介入方法、副作用、スケジュールなどその説明内容は多岐に渡る。一方で「研究の社会的意義」についてどの程度意識して説明をしているだろうか。最新の「人を対象とする生命科学・医学系研究に倫理指針( 以下、生命科学・医学系指針)」では、その基本方針の中で「研究により得られる利益及び研究対象者への負担その他の不利益を比較考量すること」と明記されている。これは、研究のリスク・ベネフィットを評価する際に「研究対象者の負担・不利益」と「研究により得られる利益」を比較することを示している。「研究により得られる利益」とは、被験者本人に限定される利益だけではなく、研究本来の目的である「将来の社会に対する利益( 社会的利益)」を指しており、即ち研究を正当化するためにも「研究の社会的意義」が重要な位置付けであることが生命科学・医学系指針からも分かる。
本講演では「なぜICが必要か?」といった基本的な考え方や注意点を説明すると共に、本講演の主目的である研究の社会的意義等を考える際のポイントについて解説することでICについての理解を深めたい。
演者:松山 琴音(日本医科大学 医療管理学)
step 5移行を目前にしているICH E8(R1)では、臨床試験における品質管理は予め試験デザインやプロセスに「質」を作り込むこと、即ちQuality by Designの導入が求められている。しかし、現状では試験デザインやプロセスは未だ一部の限られた立場の者により検討・構築され、現場では臨床試験のプレイヤー( ステークホルダー) が各々、自身が正しいと考える品質管理の取り組みを行っており、プレイヤー間のすれ違いが生じている。では、どうすればこのすれ違いを回避できるのか。そもそも、臨床試験の質とはどのように考えられるべきなのか。
臨床試験にはそれぞれ目的・目標があり、臨床試験の質はその目標に見合ったものでなくてはならない。その臨床試験が「被験者を保護しつつ、重要な疑問に答え、意思決定を支援するための信頼できる情報」について、「生成される情報の質は、適切な意思決定を支援するのに十分であるべき」である。また、「実施計画とプロセスに品質を設計することによって、試験の品質を積極的に推進する」ことについては、多くのStakeholderと共に、どのように達成するかについての明確なコミュニケーションを実施する必要がある。今後は、臨床試験に関与する全てのプレイヤーが試験目的に則した品質目標を共有し、ステークホルダー間の対話を通じて適切なCritical to Quality factorsを設定し、試験デザインやプロセスに「質」を反映させていくことが必要となる。また、各プレイヤーは自身が担当する範囲に求められている品質に責任を負うために、日常業務のプロセス改善も含めた、業務の最適化を定常的に行うことを求められるようになるだろう。本セッションでは、ICH E8(R1)で示された臨床試験の「質の確保」とはどのようなことなのかを解説した上で、今後の臨床試験の目的と求められる「質」、医療機関とSponsor それぞれに求められる質の確保に向けた活動について、日々の業務に活かす観点から具体的に示す。
なお、本教育オンデマンドは「リスクに基づく臨床試験の品質管理において、医療機関とSponsor に求められる役割を考える」ワークショップと連携した構成となっていることを申し添える。
演者:折原 英里(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
1996 年に作成されたICH E6 ガイドラインは、技術革新や“risk-based approach” といった新たな概念に対応することを目的に2016 年にE6(R2) として改訂された。その際、アカデミアの国際コンソーシアム等より、試験の多様化に伴う被験者のリスクの相違への配慮等に関してICH及びEMAにパブリックコメントとして寄せられたため、ICHはICH E8ガイドラインの近代化及びそれに続くE6ガイドラインの改訂に関する計画としてGCP renovationを公表した。E6(R3)の改訂後のガイドラインは、「Overarchingprinciples and objectives」、及びその傘下に位置する2 つのAnnex(Annex 1 及びAnnex 2) から構成される。Overarching principles and objectivesはガイドライン全体の原則、Annex 1はtraditionalな介入試験に関する内容、Annex 2 はその他の介入試験に関してAnnex 1 までの内容に加えて更に追加で考慮が必要な点が含まれる予定である。E6(R3)の作業部会の活動経緯としては、2019年6月のICHアムステルダム会合にて新規トピックとして採択され、同年11月のICHシンガポール会合での対面会合においてConcept paper 及びBusiness plan が承認された。2020 年5 月には、対面会合を予定していたICHバンクーバー会合をコロナ禍によりバーチャル会議として実施し、主にOverarching principles andobjectives に含まれるPrinciples( 原則) の文書に関して議論を進めた。その後も2020 年5 月と11 月、2021 年5-6 月、2021 年11 月に予定されていた対面会合はバーチャル会議として実施され、主に上述のPrinciples(原則)及びAnnex 1の文書に関して議論を進めた。併せて2021年4月にはPrinciples部分のドラフトを公開し、5 月にpublic web conference を開催した。また、改訂にあたっては、アカデミア等の様々なステークホルダーからの意見を取り入れながら検討を進めている。直近では、2022 年5 月にICH アテネ会合を対面及びバーチャル会議のハイブリッド形式として実施し、Annex 1 に関する議論を進めた。
今後について、現時点では、2022 年9 月を目処にPrinciples 及びAnnex 1 について、Step 1 に到達することを目標としている。また、Annex 2の作成に向け、Concept Paperの改訂を行う予定である。Annex 2の具体的な内容の検討については、Annex 1がStep 1に到達以降に開始する予定である。本セッションにおいてはICH E6(R3)ガイドラインへの最新の検討状況及び今後の予定について共有したい。
ムコネットTwinkle Days 中井まりさんのご長男は、2 歳の時に希少難病であるムコ多糖症2 型と診断されました。当時確立された治療法がない中、アメリカで行われている試験に参加するため、家族を日本に残しご長男を連れてアメリカに渡りました。その当時の中井さんの様子を取材されたドキュメント番組の放映をきっかけに支援活動が広がり、日本のドラッグ・ラグ問題が注目され、異例の早さで新薬が承認される事となりました。中井さんは現在も活動を続けておられます。そして2021 年には新たな薬が承認され、ご長男はその臨床試験に参加されておられます。 海外での治験と日本での臨床試験に参加された患者家族の立場から、創薬にかかわるものへメッセージをいただきます。
私は長男が生まれた時から体の硬さなどの違和感を持ちながら不安な毎日を過ごしていましたが、2歳で進行性の希少難病ムコ多糖症2型と診断されました。命にかかわる大変な病気にも関わらず、当時は治療薬が無く、毎年同じ病気の子どもたちが亡くなっていることを目の当たりにしました。そのような中、唯一骨髄移植をすれば、病気の進行を抑えられるかもしれないことを知り、骨髄バンクの活動に参加させていただきましたが、ドナーは見つかりません。数年後、大学病院の医師から海外の治験参加を勧めていただき、アメリカのテキサスこども病院の治験に参加することにしました。この治験は三重盲検で長男にはあまり効果を感じることはできませんでしたが、現地スタッフのみなさんに 右も左も分からないまま日本から来た親子を温かく迎えてもらえ、実際に効果を体感している患者さんと出会えて、一年半に及ぶ海外の治験から帰国することができました。そして、治験参加中に日本テレビの取材を受けることになり、2005年5月に放送されたドキュメント番組がきっかけとなって、多くの方々がドラッグラグ問題に関心を持ってくださり、多くの方々のおかげで治療薬が早期承認されました。現在、長男が診断されてから22年、アメリカで開発された治療薬が日本で承認されて14年以上経ちました。薬の効果が届かない病変と闘いながらも大人になることが出来ました。同病の仲間が志望大学に合格しました。子どもたちも成長しています。薬の審査の仕組みが変わったことによって、昨年は日本で開発された新薬が承認され、長男は「自らも役に立ちたい」「元の薬のままでは何も変わらない」と、臨床試験に参加しています。この薬を始めてからしばらく副反応で苦しい思いをしましたが、毎週の治療薬投与や検査入院と、仕事を両立させてがんばっています。わが家のこれまでの20年余りの経験とこれからのことを考えながら、創薬にかかわるみなさんへ少しでも何かお伝えできればと思いお話しさせて頂きます。
演者:下井 辰徳(国立研究開発法人 国立がん研究センター中央病院腫瘍内科)
未承認薬等を迅速に保険外併用療養として使用したいという困難な病気と闘う患者さんの思いに応えるため、患者さんからの申出を起点とし、安全性・有効性等を確認しつつ、できる限り身近な医療機関で受けられるようにする制度として患者申出療養制度が導入されてから5 年が経過した。しかし、その数は必ずしも多くなく、申し出を行う患者および申請を行う医療機関にとっても、手続きの煩雑さや人的・予算的な負担が大きいものとなっている。
2022 年は8 番目の患者申出療養である 「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」について 計画の変更が了承され、がん領域では完全リモート治験も開始される。地方においても「患者申出療養」制度を利用し、身近な医療機関で先進的な治療を受けられる時代の到来に向けて、その概要と現状を学びましょう。
演者:下野 航(独立行政法人 医薬品医療機器総合機構 信頼性保証部)
治験とは、医薬品医療機器等法第2条の定義によれば、医薬品等の製造販売の承認申請資料のうち、臨床試験の試験成績に関する資料の収集を目的とする試験の実施を指す。そのような治験に携わり始めて1〜3年目の皆様は、CRCであれば原資料の作成、症例報告書への入力、同意取得時の補足説明等、治験事務局員であれば治験記録の保管等、CRAであればモニタリング、副作用情報の提供等、日々の業務を実施する際に、医薬品の臨床試験の実施の基準(GCP)に関する省令を遵守するよう常に意識していると思う。現在のGCP省令(新GCPともいう)は1997年に制定されたが、その以前には旧GCP(1990年)、答申GCP(1997年)と呼ばれる前身が存在し、旧GCP、答申GCPの制定以前には、制定されるに至る経緯(サリドマイド事件、スモン事件、タスキギー事件等)があった。また1997年のGCP省令制定以降も、国内の治験環境における変化や国際的な規制調和への対応等を目的にGCP 省令は10 回以上改正され、今日の内容となっている。さらに今後も、治験を取り巻く環境の変化に応じ、改正されていくことが予想される。GCP 省令制定の目的は第1 条に掲げられているように、被験者の人権の保護、安全の保持及び福祉の向上を図り、治験の科学的な質及び成績の信頼性を確保することである。PMDA 信頼性保証部は、製薬企業等から承認申請される医薬品等に関し、申請資料中の臨床試験の成績に関する資料がGCP省令の他、申請資料の信頼性の基準( 医薬品医療機器法施行規則第43 条) を遵守して実施され、作成されているかを適合性調査として確認している。この調査のうち、GCP省令への適合性を確認するものをGCP実地調査と呼ぶ。PMDAは治験が治験実施医療機関において被験者の人権等への配慮がなされて実施されていたか、また、有効性や安全性の評価に影響を及ぼすようなデータの信頼性に関する問題はないかといった視点で、GCP実地調査を実施している。以上のように、承認申請された医薬品の有効性及び安全性の治験成績を審査する大前提として、治験がGCP 省令を遵守して実施されていることが不可欠である。適正に治験を実施する担い手としての治験現場で日々奮闘する皆様の活躍に期待している。本演題では、治験実施医療機関、治験依頼者等のビギナー(治験に関与して1~3年目)の皆様を対象に、治験とGCP、適合性調査についてわかりやすく説明する。
演者:成田 さわな(熊本大学病院 臨床試験支援センター)
医療技術の進歩の影で研究計画・研究支援が直面している問題は益々複雑化しており、効果的な多様性の導入が喫緊の課題と考えられる。このような研究環境の変化の中、AMEDの研究事業において、研究者と研究支援者(PM/統計家/DM/CRC/CRA/倫理担当者)が研究計画の早期段階から協働することで、各支援者の持つコンピテンシーの相乗作用を通して、効果的に研究計画骨子の作成・ブラッシュアップができるプログラムが開発された。我々は、この度、その概略と研究立案段階における多職種協働の有用性をシンポジウムにて紹介(シンポジウム3)し、更にシンポジウムに連動する形で、研究概要(シノプシス)のブラッシュアップの一部を経験いただけるワークショップを企画した(ワークショップ2)。これらの企画に参加いただく際に、基本的な臨床研究支援に関する知識を事前に把握いただくことで、より充実した時間を過ごせると考え、教育オンデマンド動画を作成した。是非、E11「臨床研究支援のこれからのあるべき姿を見据えて(事前学習用)」をご視聴いただき、シンポジウム3及び/又はワークショップ2に臨んでいただければ幸いである。
※リンクのご了承を得ておりますので、サイトポリシーをご確認の上ご利用ください。
:「臨床研究をもっと身近に」
▶︎ ICR臨床研究入門
:「Fair Market Value」と「ベンチマーク型コスト」という用語解説
▶︎ 製薬協による解説
▶︎ R&D Head Club
共催セミナー
〜誰かのためでなく、患者さんとすべての関係者のために〜」(現地+WEB)
9月17日(土) 12:10~13:10
第2会場(朱鷺メッセ 新潟コンベンションセンター 2F メインホールA)
座長:渡部 歌織(東京大学医学部附属病院 臨床研究推進センター)
座長:水戸部 学(R&D Head Club Working Group2/日本イーライリリー株式会社)
演者:榎本 有希子(日本大学医学部附属板橋病院 臨床研究センター)
演者:黒瀬 陽子(ファイザーR&D合同会社)
共催:R&D Head Club
~今求められるQualityとRBMの意味について、共に考えよう~」(現地+WEB)
9月17日(土) 12:10~13:10
第3会場(朱鷺メッセ 新潟コンベンションセンター 2F メインホールB)
座長:石塚 健二(米国研究製薬工業協会 臨床部会/グラクソ・スミスクライン株式会社)
座長:内田 智広(欧州製薬団体連合会 臨床部会/ノバルティスファーマ株式会社)
演者:鎌倉 望(アッヴィ合同会社)
演者:平井 侯成(バイエル薬品株式会社)
共催:PhRMA/EFPIA Japan
9月17日(土) 12:10~13:10
第4会場(朱鷺メッセ 新潟コンベンションセンター 2F 中会議室201)
座長:森下 圭(アズワン株式会社 サービスプロモーショングループ グループ長)
演者:前川 知巳(アズワン株式会社 サービスプロモーショングループ)
共催:アズワン株式会社
9月17日(土) 12:10~13:10
第5会場(朱鷺メッセ 新潟コンベンションセンター 3F 中会議室301)
座長:長谷山 貴博(アガサ株式会社 カスタマーサクセス部 マネージャー)
〜セントラルIRBでの実用例の報告〜
田中 千恵子(株式会社アイロム グループクオリティマネジメントセンター 治験事務局支援部 アイロム担当グループ)
鎌倉 千恵美(アガサ株式会社 代表取締役社長)
共催:アガサ株式会社
9月17日(土) 12:10~13:10
第6会場(朱鷺メッセ 新潟コンベンションセンター 3F 中会議室302)
座長:浅野 健人(大阪大学医学部附属病院 未来医療開発部 臨床研究センター 副センター長/特任准教授)
演者:松山 琴音(日本医科大学医療管理学/学校法人日本医科大学研究統括センター)
〜フィージビリティ・プロジェクト管理・リクルートメント・リテンションを一元管理〜
演者:猪川 崇輝(株式会社Buzzreach)
共催:株式会社Buzzreach
9月17日(土) 12:10~13:10
第7会場(朱鷺メッセ 新潟コンベンションセンター 4F 国際会議室)
座長:近藤 直樹(独立行政法人国立病院機構 本部)
演者:丸山 由起子(公益社団法人日本医師会 治験促進センター)
共催:公益社団法人日本医師会 治験促進センター
9月18日(日) 11:50~12:50
第2会場(朱鷺メッセ 新潟コンベンションセンター 2F メインホールA)
座長:島村 隆太郎(グラクソ・スミスクライン株式会社/TransCelerate BioPharma Inc.)
演者:齋藤 佳奈(ブリストル・マイヤーズ スクイブ株式会社/TransCelerate BioPharma Inc.)
演者:鈴木 智也(メルクバイオファーマ株式会社/TransCelerate BioPharma Inc.)
演者:安達 聖子(国立がん研究センター東病院)
共催:TransCelerate BioPharma Inc.
9月18日(日) 11:50~12:50
第3会場(朱鷺メッセ 新潟コンベンションセンター 2F メインホールB)
座長:浅野 健人(大阪大学医学部附属病院 未来医療開発部 臨床研究センター 副センター長/特任准教授)
演者:木村 雪絵(国立がん研究センター東病院 臨床研究コーディネーター室)
演者:白瀬 真由美(株式会社NTTデータ)
共催:株式会社NTTデータ
9月18日(日) 11:50~12:50
第4会場(朱鷺メッセ 新潟コンベンションセンター 2F 中会議室201)
座長:佐藤 裕(メディデータ・ソリューションズ株式会社 ソリューションコンサルティング部 ディレクター)
演者:柳生 直紀(メディデータ・ソリューションズ株式会社 ソリューションコンサルティング部 ソリューションコンサルタント)
共催:メディデータ・ソリューションズ株式会社
9月18日(日) 11:50~12:50
第5会場(朱鷺メッセ 新潟コンベンションセンター 3F 中会議室301)
座長:松山 琴音(学校法人日本医科大学研究統括センター)
演者: 長谷部 靖明(Activaid株式会社)
演者:高岡 敏(株式会社リニカル 育薬事業部)
演者:松山 琴音(日本医科大学医療管理学/学校法人日本医科大学研究統括センター)
共催:Activaid株式会社
9月18日(日) 11:50~12:50
第6会場(朱鷺メッセ 新潟コンベンションセンター 3F 中会議室302)
座長:松永 拓真(株式会社MICIN オンライン医療事業部 DCTユニット Business Producer)
演者1:砂川 優(聖マリアンナ医科大学 臨床腫瘍学講座 主任教授)
演者2:岩見 さゆり(シミックヘルスケア・インスティテュート株式会社 SSIカンパニー関東エリア西関東オフィス)
共催:株式会社MICIN
9月18日(日) 11:20~12:50
第7会場(朱鷺メッセ 新潟コンベンションセンター 4F 国際会議室)
座長1:三嶽 秋久(日本SMO協会 会長)
座長2:植松 尚(一般社団法人 日本CRO協会 会長)
演者:宮田 俊男(早稲田大学 理工学術院 教授)
パネリスト:松澤 寛(日本製薬工業協会/アステラス製薬株式会社)
後藤 美穂(日本SMO協会/トライアドジャパン株式会社)
吉見 尚人(一般社団法人日本CRO協会/エイツーヘルスケア株式会社)
共催:日本SMO協会/一般社団法人 日本CRO協会
10月3日(月)~10月31日(月)
座長:植松 尚(一般社団法人 日本CRO協会 会長)
演者:木次 佳太(サン・フレア アカデミー)
共催:一般社団法人日本CRO協会/サン・フレア アカデミー
〜より身近になりつつあるリモートアクセスによる原資料の閲覧〜【オンデマンド配信】
10月3日(月)~10月31日(月)
座長:下河辺 純一(一般社団法人日本CRO協会)
演者:笹浪 和秀(一般社団法人日本CRO協会/シミック株式会社)
演者:中嶋 翔(IQVIAサービシーズジャパン株式会社)
パネリスト:宮崎 敦(佐賀県医療センター好生館 総合臨床研究所)
佐々木 美緒(株式会社EP綜合)
金田 侑子(ノバルティスファーマ株式会社)
中川 悠(アストラゼネカ株式会社)
共催:一般社団法人 日本CRO協会





